PERFILES
21
CONSTRUCCIÓN DEL DIAGRAMA DE FASES
DEL DIÓXIDO DE CARBONO
El diagrama de fases de una sustancia pura muestra las regiones de presión-temperatura en las que las varias fases de una
sustancia (típicamente sólido, líquido y gas) son estables. En este trabajo se detalla la construcción del diagrama de fases
del dióxido de carbono a partir de sus valores de punto triple, punto crítico y otras propiedades termodinámicas usando las
ecuaciones de fronteras de fases sólido-líquido, líquido-gas y sólido-gas de una sustancia pura. El ejercicio provee una simple
e interesante actividad en clase para un curso de química física o de termodinámica.
Palabras clave: Diagrama de fases, CO
2
, Punto triple, Punto crítico, Ecuaciones de frontera
Keywords: Phase diagram, CO
2
, Triple point, Critical point, Frontier ecuations
The phase diagram of a pure substance shows the regions of pressure-temperature in which the several phases of a substance
(typically solid, liquid and gas) are stable. In this work, the construction of the carbon dioxide phase diagram from its values
of triple point, critical point, and other thermodynamic properties is detailed. The exercise provides a simple, interesting class
activity for a physical chemistry or thermodynamics course.
Robert A. Cazar
1,2
1
Escuela Superior Politécnica de Chimborazo
2
Grupo Ecuatoriano para el Estudio Experimental y Teórico de Nanosistemas -GETNano
Autor para correspondencia: robert.cazar@gmail.com
Fecha de recepción: 15 de marzo de 2013 - Fecha de aprobación: 25 de julio de 2013
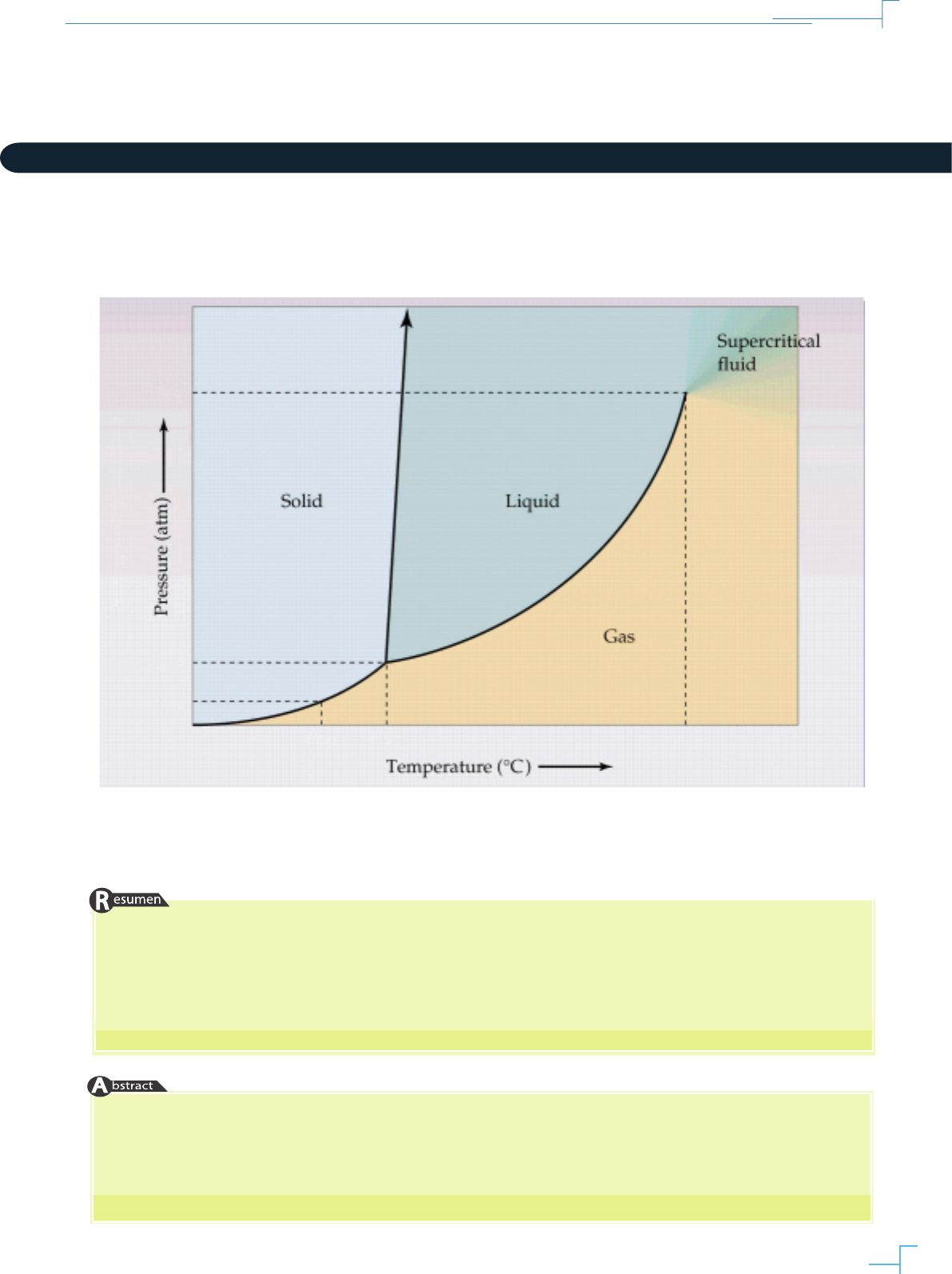
Imagen ilustrativa: Phase diagram of carbon dioxide. Fuente: http://web.lincoln.k12.mi.us

PERFILES
22
1. INTRODUCCIÓN
El diagrama de fases de una sustancia pura es
sumamente informativo de su comportamiento.
Permite, entre otras cosas, visualizar la estabili-
dad relativa de las diversas fases de la sustancia
como función de la temperatura y presión ade-
más de predecir y controlar las transiciones entre
fases variando aquellas propiedades (Atkins & De
Paula, 2008). La Figura 1 muestra el diagrama de
fases de una sustancia pura típica.
En el gráco, las líneas que separan a las fases
se denominan fronteras de fases y ellas contie-
nen los valores de presión y temperatura a las
que dos fases coexisten en equilibrio. Dos pun-
tos fundamentales del diagrama de fases son el
punto triple, combinación de valores de presión
y temperatura a los cuales las tres fases coexisten
en equilibrio, y el punto crítico, conjunto de va-
lores de presión y temperatura por encima de los
cuales desaparece la frontera de fase entre líquido
y vapor dando lugar a una sola fase uida deno-
minada uido supercrítico (De Voe, 2010). Tanto
el punto triple como el punto crítico son únicas
para cada sustancia y no pueden ser manipuladas
por el observador. Para el agua, por ejemplo, el
punto triple ocurre a temperatura de 273.16 K y
presión de 0.00611 bar, en tanto que su punto crí-
tico aparece a 647.15 K y 220.89 bar. La presión
del punto triple marca la presión más baja a la
cual la sustancia puede existir como líquido, por
debajo de ella solamente la fase sólida o la fase
gaseosa pueden ser encontradas (Levine, 2008).
2. MATERIALES Y MÉTODOS
La ubicación de las curvas de frontera de fases
se calcula aprovechando el hecho que sobre ellas
un par de fases coexisten en equilibrio y en con-
secuencia sus potenciales químicos son iguales
(Atkins & De Paula, 2008):
En la ecuación (1), a y b son las fases en equili-
brio. Solucionando tal ecuación para p como fun-
ción de T se producen las ecuaciones para las tres
fronteras de fase. Así, la ecuación de la interfase sólido-líquido es:
En la ecuación (2), ∆H
fus
y ∆V
fus
son la entalpía de fusión y el cambio de
volumen molar debido a la fusión, respectivamente. Los valores de p* y
T* corresponden a los del punto triple.
La ecuación de la interfase sólido-vapor es:
En esta ecuación, ∆H
sub
es la entalpía de sublimación de la sustancia y R
es la constante universal de los gases. Los valores de p* y T* nuevamente
corresponden a los del punto triple.
La ecuación de la interfase líquido-vapor es muy similar a la anterior:
En ella, ∆Hvap es la entalpía de vaporización de la sustancia. Puesto que
esta curva se extiende desde el punto triple hasta el punto crítico para
p* y T* se usan dos sets de valores, esto es, los del punto triple para la
región de la curva en la vecindad de este punto y los del punto crítico
para la región de la curva en las proximidades de este punto.
3. RESULTADOS Y DISCUSIÓN
Para construir el diagrama de fases del dióxido de carbono se usaron los
datos que se listan en la tabla I (Atkins & De Paula, 2008).
Algunos puntos que representan la interfase sólido-líquido del CO
2
, ob-
tenidos aplicando la ecuación 2, se muestran a continuación:
La siguiente tabla recoge algunos puntos que corresponden a la interfase
líquido-gas del CO
2
.
Figura 1. Diagrama de fases de una sustancia pura
típica. Los puntos rotulados T y C corresponden al
punto triple y al punto crítico, respectivamente.
Tabla 1. Datos requeridos para construir el diagrama de fases del dióxido de
carbono.
Tabla 2. Puntos de la interfase sólido-líquido del CO
2
Tabla 3. Puntos de la interfase líquido-gas del CO
2
(1)
(2)
(3)
(4)
Volumen molar del sólido: 28.765 cm
3
/mol
Volumen molar del líquido: 56.423 cm
3
/mol
∆Hsub = 25.2 kJ/mol
∆Hfus = 8.3 kJ/mol
Punto triple: 216.15 K, 5.2 bar
Punto crítico: 304.15 K, 74 bar
T(K) p (bar)
216.15 5.2
218.15 32.8
220.15 60.2
222.15 87.4
223.15 100.8
T(K) p(bar)
216.15 5.2
223.15 7.0
233.15 10.3
243.15 14.8
- -
- -
283.15 45.1
293.15 57.6
304.15 74.0
µµ
ab
pT pT
,,
()
=
()
pp
H
V
T
T
fus
fus
=+
*ln
*
∆
∆
ppe
H
RTT
sub
=
−−
*
*
∆
11
ppe
H
RTT
vap
=
−−
*
*
∆
11

PERFILES
23
Tabla IV se listan algunos puntos de la interfase sólido-gas del CO
2
:
El gráco generado al representar los puntos calculados sobre papel
milimetrado se muestra en la Figura 2.
Del diagrama se observa que la curva sólido-vapor tiene pendiente po-
sitiva, por tanto la temperatura de fusión del CO
2
, al igual que la de la
mayoría de sustancias, aumenta cuando se incrementa la presión a la que
está sometido. Muy pocas sustancias, entre
ellas el agua, muestran un comportamiento
opuesto al descrito, esto es, una curva sólido-va-
por con pendiente negativa. Para tales sustancias
el punto de fusión disminuye cuando aumenta la
presión a la que están sometidas.
Este comportamiento explica también el hecho
que el H
2
O, al contrario de la mayoría de sustan-
cias, se expande al congelarse; normalmente, una
sustancia se contrae al congelarse (Cengel & Bo-
les, 2009), éste es el caso del CO
2
.
El diagrama de fases del CO
2
también evidencia
que a presión ambiental esta sustancia no puede
existir en fase líquida, esto se debe a su muy alta
presión de punto triple (5.2 bar). Ello explica por
qué en condiciones normales de presión la única
transición de fase observable en el CO
2
es la su-
blimación, esto es, el cambio directo de sólido a
gas (Atkins & De Paula, 2008).
4. CONCLUSIONES
En este artículo se ha descrito la construcción del
diagrama de fases del CO
2
usando las ecuaciones
de fronteras de fases y ciertos datos termodiná-
micos de esta sustancia. El diagrama obtenido
permite visualizar las regiones p-T en las que son
estables las fases líquida, sólida y gaseosa del CO
2
y entender cómo se puede controlar aquellas va-
riables para producir transiciones entre estas fa-
ses. El trabajo provee una actividad en clase sim-
ple y atractiva para un curso de química física o
termodinámica.
Tabla 4.: Puntos calculados de la interfase sólido-gas del CO
2
Figura 2. Diagrama de fases del CO
2
obtenido a partir de los cálculos efec-
tuados.
T(K) p(bar)
203.15 2.1
208.15 3.0
213.15 4.3
216.15 5.2
Atkins, Peter. & De Paula, Julio. Physical Chemistry, 8th edition. New York: W. H. Freeman, 2006.
Cengel, Yunius. & Boles, Michael. Termodinámica, 6ta edición. México: McGraw Hill, 2009
De Voe, Howard. Thermodynamics and Chemistry, 2nd edition. Maryland: Creative Commons, 2010
Levine, Ira. Physical Chemistry 6th edition. Boston: McGraw Hill, 2008.