
Toaquiza-Aguagallo, Mera-Balseca. Toasa-López, Morales-Yuste
9
RESISTENCIA ANTIBIÓTICA EN NIÑOS CON SÍNDROME
DIARREICO AGUDO BACTERIANO EN UN HOSPITAL
PEDIÁTRICO DE RIOBAMBA, ECUADOR
1
Norma-Cecilia Toaquiza-Aguagallo,
1
Jacinto Mera-Balseca,
2
Rosa-María Toasa-López,
1,3
Manuel Morales-Yuste.
1
Escuela de Bioquímica y Farmacia. Facultad de Ciencias.
Escuela Superior Politécnica de Chimborazo. Chimborazo, Ecuador.
2
Hospital Pediátrico Alfonso Villagómez de Riobamba. Laboratorio clínico.
Chimborazo, Ecuador.
3
Departamento de Parasitología. Facultad de Farmacia, Universidad de Granada.
Granada, España.
e-mail: cecytoaquiza@gmail.com
R
esumen
Entre las principales causas de morbimortalidad infantil se encuentra el síndrome diarreico agudo
(SDA) de origen bacteriano, lo que, asociado al importante incremento de bacterias resistentes a los
tratamientos antibióticos, constituye un problema de salud pública que afecta a países desarrollados y
en vías de desarrollo. En el presente estudio, se ha determinado la resistencia de Escherichia (E.) Coli
y otras bacterias enteropatógenas frente a antibióticos en niños con SDA de origen bacteriano atendidos
en el Hospital Pediátrico Alfonso Villagómez Román del cantón Riobamba, Ecuador. Se examinaron
1924 muestras de heces diarreicas y, sobre la base del diagnóstico médico inicial, fueron seleccionadas
para coprocultivo 106 muestras. El trabajo ha permitido identificar un alto porcentaje de niños infecta-
dos con E. coli potencialmente patógena (95,1%), y se han verificado diversas resistencias antibióticas
frente a dicho agente bacteriano. Estos ensayos han evidenciado la existencia de un elevado porcentaje
de cepas de E. coli multirresistentes y productoras de SDA en los niños, con las consecuentes implica-
ciones sobre la consecución de los objetivos terapéuticos e integridad física de los pacientes.
Palabras claves: multirresistencia, síndrome diarreico agudo, Escherichia coli, pediatría
A
bstract
Acute Diarrheal Syndrome of bacterial origin is one of the main causes of infant morbi-mortality,
which along with the significant increase of bacteria resistant to the antibiotic treatments, represent a
public health issue affecting both developed and developing countries. In the present work, the resis-
tance levels of Escherichia (E.) coli and other enteropathogenic bacteria have been assessed against
antibiotics on children with ADS of bacterial origin, who were treated in the Pediatric Hospital Al-
fonso Villagómez Román, at Riobamba (Ecuador). 1924 samples of diarrheal feces have been exa-
mined, 106 of which were selected according to the initial medical diagnosis. The study has allowed
identifying a high percentage of children infected with potentially pathogenic E. coli (95,1%), and
several antibiotic resistances against this bacterial agent have been proved. Thus, the tests have re-
vealed the existence of a large proportion of multiresistant E. coli strains, which cause ADS in chil-
dren and make a negative effect on the achievement of their therapeutic goals and physical integrity.
Keywords: multidrug resistance, acute diarrheic syndrome, Escherichia coli, pediatrics

10
INTRODUCCIÓN
La resistencia bacteriana a los antibióticos es un fenóme-
no que se da desde que se iniciaron los primeros trata-
mientos con penicilina (1). De forma general, las resisten-
cias siempre están relacionadas con el material genético,
y existen dos tipos: aquellas mediadas por mecanismos
intrínsecos o presentes de forma natural en el genoma
bacteriano —AmpC o β-lactamasa—, y las mediadas por
procesos adquiridos o mutaciones en genes y que pue-
den transmitirse a través de elementos móviles del ge-
noma tales como plásmidos, transposones, bacteriófagos,
etc. (2). Este segundo tipo de resistencias se debe, por
tanto, a la presión selectiva que ejercen ciertos grupos
de antibióticos sobre las bacterias. En la actualidad, se
conocen más de 1000 resistencias mediadas por β-lacta-
masas en bacterias gramnegativas, enzimas capaces de
romper los anillos β-lactámicos, evadiendo así la acción
de diversos grupos de antibióticos (3). En un principio, se
estableció que la principal causa de aparición de resisten-
cias bacterianas era el uso inapropiado de medicamentos
antimicrobianos destinados a humanos, en especial por
la disminución de los tiempos de tratamiento y el em-
pleo de concentraciones subterapéuticas. Actualmente
sabemos que además del factor humano existen otros re-
lacionados con la medicina veterinaria o la promoción
del crecimiento y la medicina preventiva en agricultura,
acuicultura y horticultura que están disparando la apa-
rición de resistencias. Se ha estimado que solo para es-
tas tres últimas ramas productivas son generadas entre
100.000 y 200.000 toneladas/año de antibióticos (4). A
estos elementos causantes de resistencias adquiridas hay
que sumar el efecto de la propia polución ambiental sobre
los microorganismos, fenómeno que, en los últimos años,
ha adquirido especial importancia (5). La presencia de
cepas bacterianas patógenas resistentes a los tratamientos
convencionales es un problema que en las últimas déca-
das se ha visto incrementado a nivel mundial, con espe-
cial impacto en los países tanto desarrollados como en
vías de desarrollo, y con el consecuente incremento de la
morbimortalidad de la población expuesta (6).
La diarrea es una alteración del movimiento intestinal
con consecuencias sobre el número de deposiciones
—aumento—, la consistencia de estas —semisólida o lí-
quida— y su volumen por incremento del contenido en
agua de las heces. Se presenta como un mecanismo de
protección y defensa contra las anomalías, infecciosas o
no, que pueden afectar a la microbiota intestinal. En el
caso de la diarrea de etiología infecciosa, el organismo
trata de expulsar al agente patógeno con el objeto de res-
tablecer el equilibrio del entorno gástri-
co. Sin embargo, cuando este mecanis-
mo de defensa natural adquiere carácter
crónico o se presenta de forma aguda,
puede resultar incluso más nocivo que
el propio microorganismo causal, en es-
pecial por la deshidratación que puede
provocar en el individuo afectado (7, 8).
La clasificación de las diarreas como
agudas o crónicas/persistentes depen-
de de la forma de aparición, duración y
etiología de las deposiciones. Mientras
que las diarreas agudas aparecen de for-
ma abrupta, se resuelven en las primeras
cuatro semanas y se asocian a infeccio-
nes, la forma persistente presenta una
evolución de más de cuatro semanas,
puede resultar en secundarias a infec-
ciones complicadas con otras alteracio-
nes, como malnutrición, o son debidas
a defectos congénitos ligados a la diges-
tión y/o absorción (9). La diarrea agua
o SDA constituye la principal causa de
muerte infantil en países en vías de de-
sarrollo, con una media de 1 a 3 episo-
dios anuales y una mortalidad que varía
entre el 20% y el 25% (10, 11).
Existen diferentes mecanismos fisiopato-
lógicos que pueden dar origen al SDA;
los más comunes son los de carácter os-
mótico y secretor. La forma más eficiente
de diferenciar ambos tipos de diarrea es
mediante diagnóstico de exclusión de las
causas de la diarrea osmótica, que suele
deberse a la ingestión de sales —fosfato
o sulfato de magnesio—, polisacáridos
de difícil absorción —manitol o sorbi-
tol— o por déficit de enzimas presentes
en la mucosa intestinal —lactasa—. Sin
embargo, la diarrea secretora se debe a
desequilibrios en la absorción-secreción
de electrolitos u otras anomalías que
afectan a la motilidad intestinal de origen
neuro-endocrino o metabólico (12).
Entre las principales causas de los es-
tados diarreicos se encuentran los pro-
cesos infecciosos originados por virus,
parásitos y bacterias (13). Las infec-
ciones virales suelen ser especialmen-
te agresivas, mientras que un elevado
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105

Toaquiza-Aguagallo, Mera-Balseca. Toasa-López, Morales-Yuste
11
porcentaje de las de carácter bacteriano
son autolimitantes y no es necesario re-
currir a tratamiento farmacológico, sien-
do suficiente la restitución de líquidos
y electrolitos que permita contrarrestar
los efectos de la propia diarrea. No obs-
tante, existen grupos de riesgo en los
cuales la posibilidad de complicaciones
por sepsis es elevado, destacándose los
neonatos y niños de corta edad. En estas
situaciones, el diagnóstico preliminar de
laboratorio es necesario, ya que la ins-
tauración de una terapia antimicrobiana
apropiada puede suponer la diferencia
entre la consecución de los objetivos
terapéuticos o la pérdida del paciente
(14). Tampoco podemos descartar que el
diagnóstico basado en la simple eviden-
cia clínica podría llevar a errores por las
múltiples patologías no infecciosas que
pueden derivar en diarrea —síndrome
de colon irritable, neoplasias colónicas,
inflamación intestinal, síndrome de ma-
labsorción o insuficiencia pancreática,
entre otras— (15).
Dentro del grupo de las bacterias pro-
ductoras de infecciones intestinales, la
familia Enterobacteriaceae (enterobac-
terias) adquiere especial importancia por
su ubiquidad, encontrándose en agua,
suelo y plantas, así como en la propia
flora intestinal de animales y del hom-
bre. Algunos de estos bacilos gramnega-
tivos –E. coli, Klebsiella spp., Citrobac-
ter spp., Enterobacter spp., Morganella
morganii, Proteus spp., Providencia
spp., Serratia spp., etc.— presentes en
la microbiota intestinal, en determina-
das circunstancias, pueden comportarse
como patógenos oportunistas (16). La
bacteria E. coli se ha convertido en los
últimos años en un agente especialmen-
te problemático a nivel mundial por el
amplio espectro de resistencias que es
capaz de generar, mostrando múltiples
patrones de expresión génica de la ya re-
ferida β-lactamasa, capaz de conferirle
multirresistencia antibiótica (17, 18).
En función del síndrome que originan,
son conocidos seis grandes grupos de
E. coli productora de diarrea: enteropatogénicas, en-
terotoxigénicas, enteroinvasoras, enterohemorrágicas,
difusamente adherentes y enteroagregativas (19). Las
variantes enteroagregativas y enteropatogénicas de E.
coli producen diarrea secretora mediante activación de
diversos mecanismos celulares. Estos bacilos colonizan
el tracto gastrointestinal y activan la respuesta inflama-
toria, incluyendo la respuesta mediada por enterotoxinas
que afectan a las funciones de absorción (20). Los me-
diadores inflamatorios implicados son prostaglandinas,
leucotrienos, bradiquininas y óxido nítrico (21).
Tomando como premisa inicial todos los aspectos refe-
ridos, en el presente trabajo se establecieron como ob-
jetivos la determinación de la etiología infecciosa de los
SDA en niños que acudían a una unidad pediátrica de
Riobamba; la prevalencia de E. coli en dichos síndromes
y los porcentajes de resistencia bacteriana frente a los
principales antibióticos utilizados en la zona.
MATERIAL Y MÉTODOS
Lugar y recolección de muestras
La investigación se llevó a cabo en el Hospital Pediátrico
Alfonso Villagómez Román (HPAVR) del cantón Riobam-
ba, Ecuador. La población total fueron los niños atendi-
dos entre junio y noviembre de 2014, que acudieron a los
servicios médicos mostrando síndrome diarreico agudo de
tipo infeccioso. Para el diagnóstico coprológico inicial, se
utilizaron 1924 muestras de heces, de las cuales 106 fue-
ron seleccionadas para la realización de los coprocultivos
en función de una serie de criterios preestablecidos como
la presencia de polimorfonucleares, mucus, sangre y el
propio criterio del profesional médico a cargo.
Análisis coprológico inicial
Las heces de los niños fueron receptadas en el laboratorio
de análisis inmediatamente después de su recolección.
Como criterios de inclusión/exclusión iniciales se esta-
bleció que los niños no debían haber sido tratados con
antibióticos, al menos 72 horas antes de la toma de mues-
tras, y la garantía de ausencia de contaminación por orina
en las heces. Todos los recipientes fueron debidamente
identificados mediante una codificación específica.
Aislamiento e identificación microbiana
En la fase de cultivo, se utilizó el procedimiento de siem-
bra en caldo de enriquecimiento selectivo de tetrationato;
a continuación, los microorganismos fueron aislados en
medio Agar Sangre y Agar MacConkey. Cada incubación
se efectuó durante 24 horas.

12
Etiología
Frecuencia
(casos)
Porcentaje
(%)
Polimorfonucleares
552
29
Rotavirus
987
51
Mixtas (polimorfonucleares + rotavirus)
162
8
Otras causas
223
12
Total
1924
100
Cuadro 1. Frecuencia del SDA según diagnóstico
A los microorganismos grampositivos se les realizaron
las siguientes pruebas: catalasa, coagulasa, observación
del halo de hemolisis y sensibilidad a la bacitracina. Los
bacilos gramnegativos fueron seleccionados y sometidos
a una batería de pruebas bioquímicas: TSI o Triple Sugar
Iron; SIM o Sulfuro, Indol, movilidad; Citrato y Ureasa.
Ensayos de resistencia o antibiograma
Se determinó la susceptibilidad antibiótica mediante di-
fusión en agar con discos de papel impregnados en anti-
biótico, con base en el diámetro del halo de inhibición.
Durante la determinación de la resistencia bacteriana de
E. coli, se consideraron los siguientes grupos según lo
establecido por De la Rosa-Fraile y Prieto-Prieto (2006)
(22): resistencia a los antibióticos de un grupo o familia
de antibióticos, resistencia a tres o más agentes antimi-
crobianos de diferentes grupos.
Los antibióticos incluidos en el ensayo fueron: β-lactámi-
cos —penicilinas: ampicilina + sulbactam (10/10 mcg),
amoxicilina + ácido clavulánico (20/10 mcg)—; cefa-
losporinas: ceftriaxona (30 mcg), cefuroxima (30 mcg).
aminoglucósidos –gentamicina (10 mcg), amikacina (30
mcg), kanamicina (30 mcg)—, sulfonamidas —sulfame-
toxazol combinado con trimetoprim o sulfatrimetoprim
(23,75/1,25 mcg)—. fosfónico —fosfomicina (50 mcg)—.
Análisis estadístico
Para el análisis estadístico de los valores obtenidos, se
recurrió al software informático SPSS versión 20.0 para
Windows. La relación existente entre la multirresistencia
de E. coli y la edad de los niños se determinó mediante
la prueba Chi cuadrado (χ²), con una significación esta-
dística del 5%.
Resultados y discusión
De las 1924 muestras de heces, el 57% (1097) de los ni-
ños con SDA son de sexo masculino y el 43% (827) de
sexo femenino. Estos porcentajes son similares a los ob-
tenidos por Jafari et al. (2008) (19) en una población con
edades comprendidas entre 5 y más de 60 años, lo cual
parece indicar que la distribución por
edades de los casos de SDA se mantiene
similar en edades superiores a las de los
niños incluidos en nuestro ensayo. Mi-
randa Candelario et al. (2011) (23) han
registrado esta misma distribución en ni-
ños de entre 0-6 meses y más de 5 años.
Aunque, según las fuentes consultadas,
no existe una clara justificación para tal
diferencia de porcentajes, los resultados
obtenidos por Molbak et al. (1997) (24)
indican que el riesgo de padecer proce-
sos diarreicos en niños de corta edad es
superior en el sexo masculino. Son ne-
cesarios nuevos estudios que permitan
determinar cuál es la causa de estas di-
ferencias, en especial si los hábitos de
comportamiento de los niños pueden in-
crementar el riesgo de contagio respecto
a las niñas o si, por el contrario, existe
dimorfismo sexual en la susceptibilidad
a la infección por este tipo de patógenos
(25).
El 29% de las muestras diarreicas conte-
nían polimorfonucleares, mientras que,
como era de esperar, el 51% presenta-
ron rotavirus (cuadro 1). La presencia
de leucocitos polimorfonucleares se
asocia principalmente a infecciones de
tipo invasivo. DeWitt et al. (1985) (26)
observaron que el mejor predictor para
diarreas producidas por patógenos bac-
terianos en niños son los polimorfonu-
cleares, con una sensibilidad diagnósti-
ca del 85% y una especificidad del 88%;
aunque otros autores consideran que la
ausencia de leucocitos polimorfonuclea-
res en heces no es necesariamente indi-
cativo de diagnóstico negativo a estos
agentes infecciosos (27).
Del total de heces que mostraron poli-
morfonucleares, el 88% presentaron mu-
cus y el 4%, sangre. La sangre en heces
de individuos con diarrea agua es indi-
cativo de formas infecciosas invasivas,
siendo atribuible en el caso concreto de
E. coli a las variantes enteroinvasoras
de la bacteria (28). Aunque la presencia
de mucus en las heces de individuos con
SDA ha sido con frecuencia referida en
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105
Toaquiza-Aguagallo, Mera-Balseca. Toasa-López, Morales-Yuste
13
infecciones bacterianas, también puede
ocurrir en infecciones parasitológicas
por Cryptosporidium parvum o Giardia
lamblia, entre otros, y por rotavirus (29),
lo cual justificaría los elevados porcen-
tajes de heces con mucus detectados en
nuestro estudio; en especial por el alto
número de individuos que presentaron
rotavirus.
La mayor prevalencia de SDA de tipo
infeccioso se detectó en niños menores
de 2 años, observándose una tendencia
inversamente proporcional entre el in-
cremento de la edad y los porcentajes
de infecciones bacterianas (cuadro 2).
Un grupo de expertos en epidemiolo-
gía de la salud infantil pertenecientes a
la Organización Mundial de la Salud ha
realizado un metaanálisis sobre la mor-
talidad mundial por diarrea en niños me-
nores de 5 años, describiendo pautas de
distribución de las muertes por diarrea
crecientes en función de los grupos de
edad: 0 a 6 días, 7 a 27 días, 28 a 364
días, 1 a 4 años, a excepción del grupo
de 1 a 4 años, en el cual se registró un
ligero descenso del número de casos res-
pecto al grupo anterior (30). Carpenter
et al. (2008) (31) observaron que una
práctica muy frecuente en el ámbito
clínico es realizar diagnóstico coproló-
gico a edades tempranas o en pacientes
con pocas recidivas, reduciéndose dicho
procedimiento a favor del tratamiento
antimicrobiano sin diagnóstico previo
conforme aumenta la edad del paciente
o el número de episodios. Tal práctica
puede conducir, sin duda, a la aparición
de resistencias por aplicación de trata-
mientos sin conocer la base etiológica
de las infecciones y, por tanto, a la mor-
bimortalidad asociada.
El 76% de los coprocultivos desarrolla-
ron crecimiento bacteriano, mientras que
el 24% no presentaron bacterias. Existen
varias causas que podrían explicar di-
cha ausencia de crecimiento microbia-
no. Como es sabido, la etiología de los
SDA es muy diversa, pudiendo deberse
este porcentaje a individuos con procesos
Edad
Frecuencia (casos)
Porcentaje (%)
< 24 meses
38
36
25-47 meses
29
27
48-71 meses
19
18
72-95 meses
13
12
> 96 meses
7
7
Total
106
100
Cuadro 2. Edad de niños a los que se les realizó coprocultivo
diarreicos de etiología no infecciosa; uso de ciertos me-
dicamentos, síndrome de colon irritable, neoplasia o in-
flamación a nivel del colon, síndrome de malabsorción,
insuficiencia pancreática, o desórdenes en la motilidad
intestinal, entre otros (15). Por otra parte, existe la posibi-
lidad de que, aunque se estableció el criterio de que los pa-
cientes no hubiesen sido tratados previamente con agentes
antibióticos, en algunos casos, estos niños podrían haber
recibido terapia antibiótica en otras instituciones privadas
o públicas o, como se viene observando cada vez con ma-
yor frecuencia, hayan sido medicados por personas cerca-
nas no profesionales de la sanidad (32, 33).
En lo relativo a las especies implicadas, el 95,1% de las
infecciones intestinales en los niños con SDA del HPAVR
estaban causadas por E. coli. Estos porcentajes mayorita-
rios han sido descritos en diversos estudios, donde E. coli
fue referida como la causa más común de diarrea infec-
ciosa (27, 34). El reducido 4% de pacientes que mostraron
sangre en heces hace pensar que la mayor parte de estas
bacterias no son enteroinvasoras o enterohemorrágicas,
aunque no debemos descartar que la variante enterotoxi-
génica también ha sido asociada a heces sanguinolentas
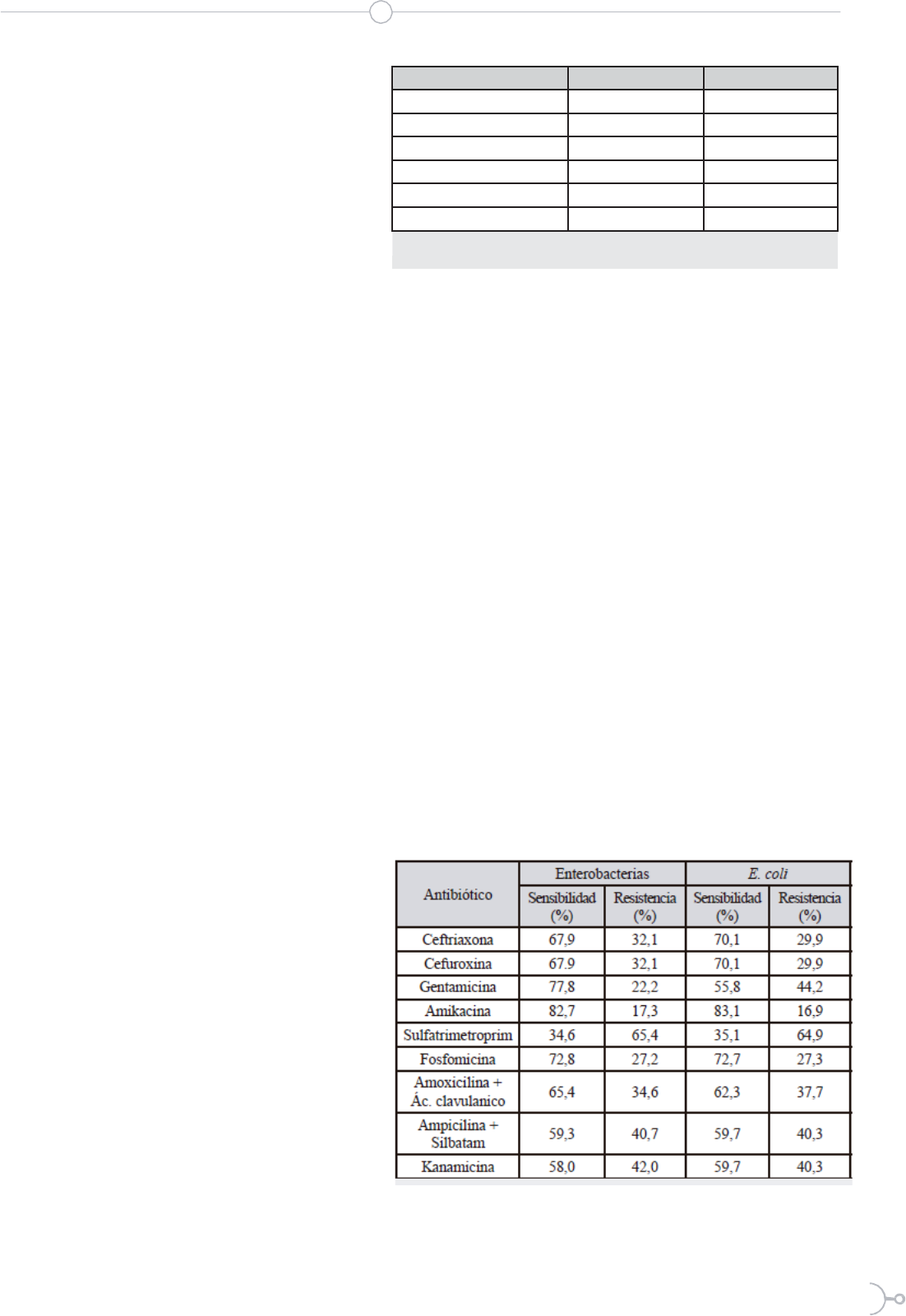
Cuadro 3. Resistencia y sensibilidad bacteriana frente
a los antibióticos ensayados
14
Nº. antibióticos
(7). En función del país o la zona geográfica, otros pa-
tógenos como Campylobacter jejuni, Salmonella spp., o
Shigella spp. pueden alcanzar igual o superior prevalencia
a la obtenida por nosotros con E. coli (12, 29, 35).
En lo que respecta a la respuesta frente a antibióticos (cua-
dro 3), las enterobacterias presentan un alto porcentaje de
resistencia frente al sulfatrimetoprim (Sullfametoxazol/
Trimetoprim) (65,4%). La resistencia frente a estos an-
tibióticos es conocida desde hace décadas, aunque se ha
visto especialmente intensificada en los últimos años. Ya
desde los años cincuenta se describieron fenómenos de
transferencia de resistencias a las sulfonamidas entre E.
coli y Shigella, dos especies que, como se ha menciona-
do, son comunes en los coprocultivos. Aunque algunos
autores como Huovinen (2001) (38) han indicado que di-
cha combinación de antibióticos está contraindicada en el
tratamiento de los procesos infecciosos gastrointestinales
por los elevados porcentajes de resistencia, el sulfatrime-
tropim continúa siendo, en muchos lugares, el tratamien-
to de primera elección en pacientes pediátricos.
Al igual que ocurre de forma general con las enterobac-
terias, en los casos de SDA por E. coli se observa un
alto porcentaje de resistencia frente al sulfatrimetoprim
(64,9%), mientras que la mayor sensibilidad se ha regis-
trado en los tratamientos con amikacina (83,1%). Re-
sultados similares obtuvieron Paniagua-Contreras et al.
(2007) (37) en México con niños de entre 2 y 12 años,
aunque la resistencia frente a la amikacina obtenida por
estos autores ha sido muy inferior (6%) con la cepas de
E. coli enterotoxigénicas, equivalente a lo ocurrido con la
ceftriaxona (5% frente al 29,9% obtenido por nosotros).
6
5
4
3
2
1
0
0 5 10 15 20 25
Porcentaje (%)
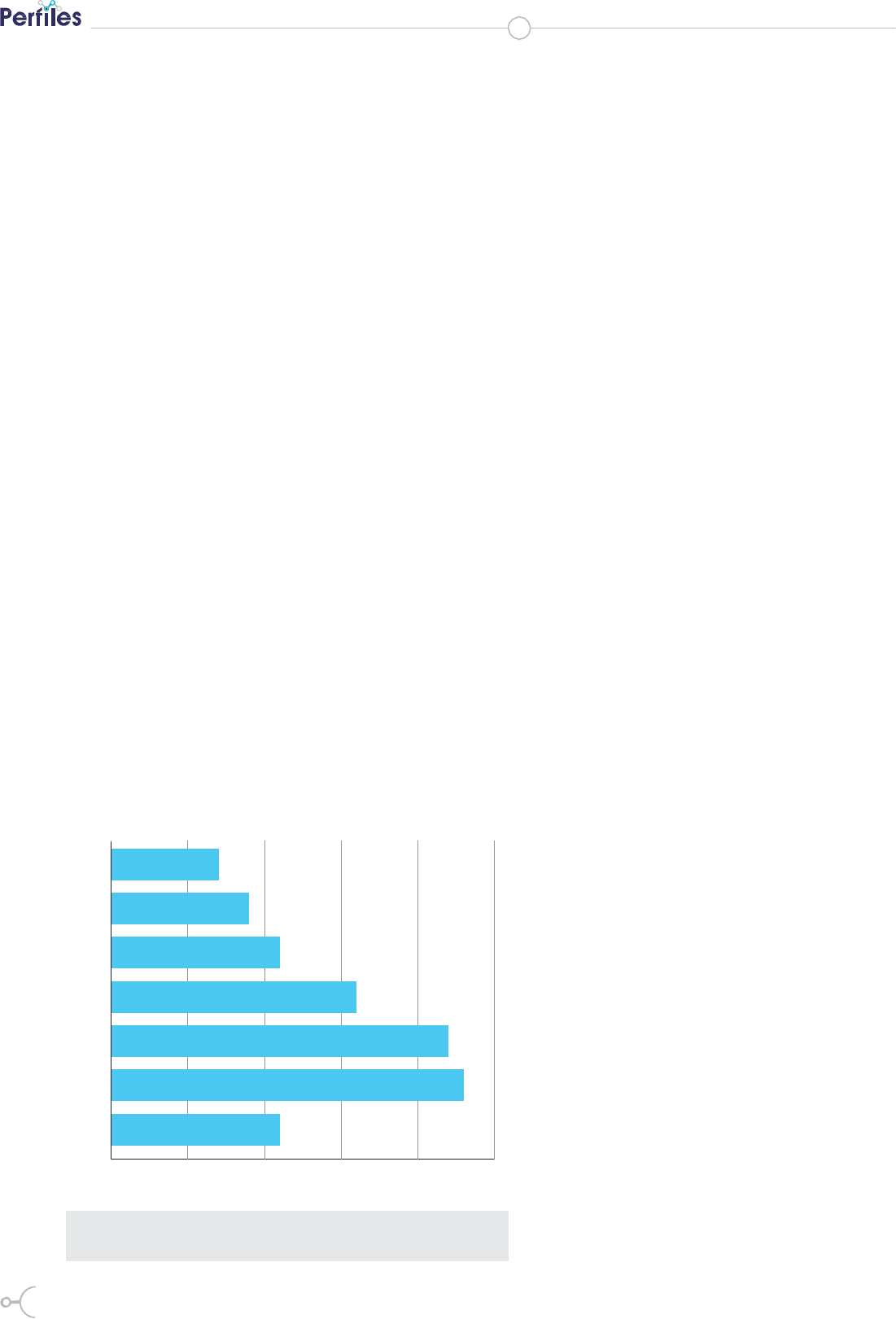
Figura 1. Distribución porcentual del total de bacterias estudiadas en
función del número de antibióticos frente a los que son resistentes.
Salles et al. (2013) (38) han realizado un
trabajo de revisión científica donde se
aportan datos sobre infecciones resisten-
tes a tratamientos antibióticos produci-
das por gramnegativos. Según el citado
estudio, Ecuador es el segundo país de
América Latina en porcentaje de cepas
de E. coli con β-lactamasas de amplio
espectro aisladas a partir de infecciones
gastrointestinales. Además, al igual que
nosotros, estos autores encontraron que
la amikacina es uno de los antibióticos
más efectivos frente a E. coli, solo su-
perado por dos fármacos pertenecientes
al subgrupo de los carbapenem —erta-
penem y imipenem—.
Del total de bacterias aisladas, un 27%
presentaron multirresistencia, entendida
como resistencia a más de tres antibióti-
cos (figura 1). Los fenómenos de multi-
rresistencia bacteriana son ampliamente
conocidos, habiendo adquirido tal im-
portancia y dimensión que, en la actuali-
dad, ya podemos hablar de enterobacte-
rias multirresistentes y extremadamente
resistentes (39). La problemática asocia-
da a estas resistencias acumuladas radi-
ca en la variedad de mecanismos cau-
santes, como pueden ser inactivaciones
mediadas por enzimas o modificaciones
que inhiben o afectan a las interaccio-
nes antibiótico-diana bacteriana (40). La
compleja etiología de las multirresisten-
cias hace que los tratamientos simples a
menudo resulten inefectivos, por lo que
cada vez se hace más necesaria la admi-
nistración combinada de estos agentes
y el diseño de nuevas moléculas. Como
se ha indicado, las mutaciones se deben
a acumulación de polimorfismos en di-
versas regiones del genoma bacteriano
que confieren a estos organismos la ca-
pacidad de resistir a la acción de uno o
varios antibióticos (41). Si se pretende
caracterizar genéticamente una determi-
nada cepa con el objeto de establecer la
terapia más efectiva, estas mutaciones
asociadas complican sobremanera dicha
tipificación y la selección de posteriores
tratamientos.
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105
Toaquiza-Aguagallo, Mera-Balseca. Toasa-López, Morales-Yuste
15
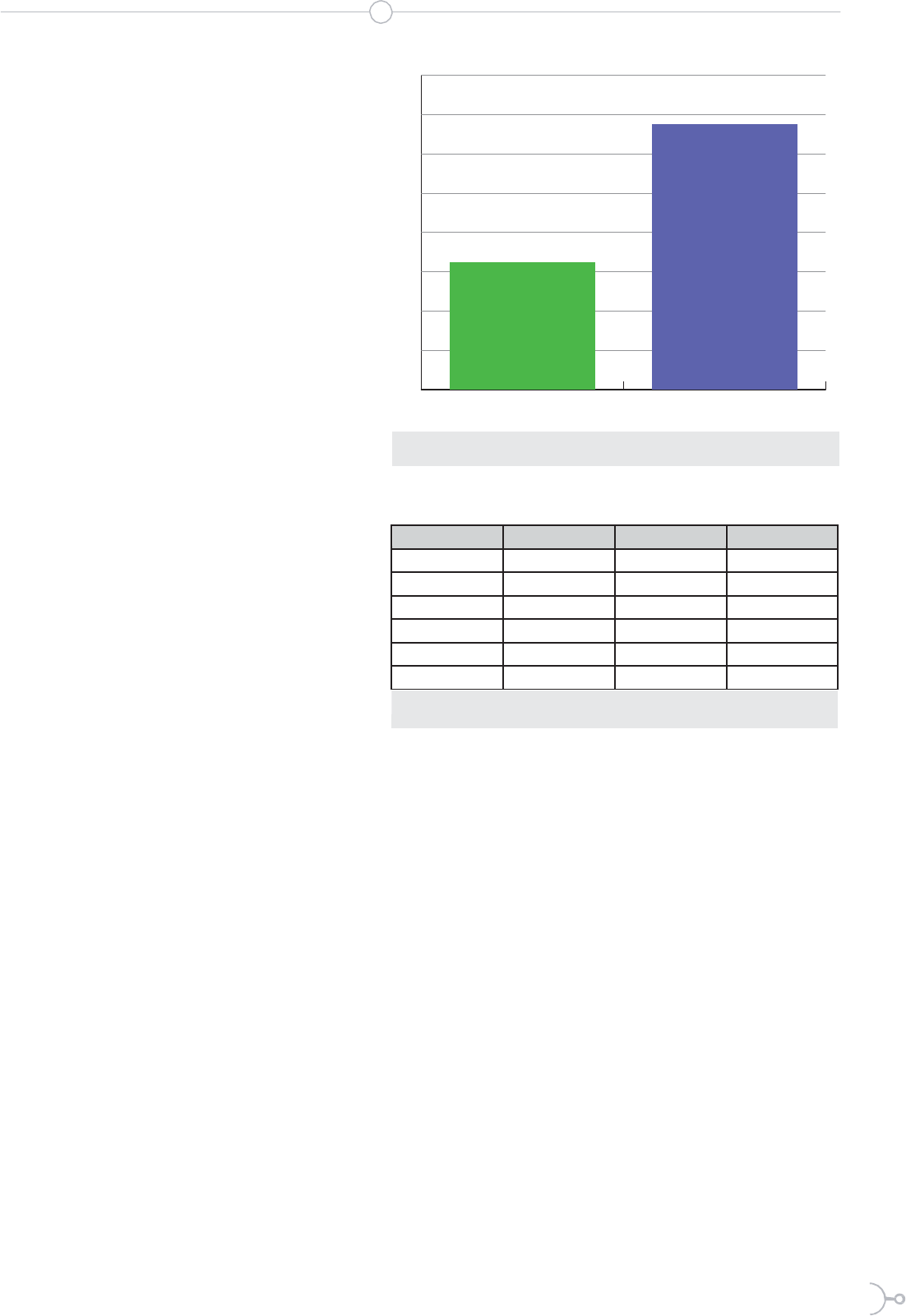
Estas alteraciones del genoma bacteria-
no explicarían que el 32,5% de cepas de
E. coli aisladas en los coprocultivos re-
sultaron multirresistentes o resistentes a
antibióticos pertenecientes a tres o más
grupos farmacológicos distintos (figu-
ra 2). Otros autores como Bustos et al.
(1995) (42) han obtenido porcentajes en
E.
coli muy superiores, con 21 de 38 ce-
pas multirresistentes (55%).
Mediante la prueba estadística de Chi
cuadrado (χ² tabulado 9,49; χ² calculado
3,28) se determinó que la aparición de
resistencias frente a E. coli no guardaba
relación con la edad de los niños (cuadro
4), pudiendo deberse tal falta de corre-
lación al uso previo de antibióticos, o a
la infección con cepas que ya portaban
resistencia para uno o varios de estos
fármacos.
Conclusiones
Del total de casos pediátricos de SDA de
origen bacteriano analizados, el mayor nú-
mero de casos (95,1%) se ha debido a in-
fecciones por E. coli, por lo que cualquier
estrategia sanitaria enfocada sobre dicha
especie tendría un especial impacto sobre
el control de este tipo de síndromes en la
región de estudio. Los bajos porcentajes
de sangre en las muestras (4%) podrían
indicar reducida presencia de cepas ente-
roinvasoras de E. coli, aunque son nece-
sarios nuevos estudios de caracterización
molecular que avalen estos resultados.
Mientras que la edad de los niños es inver-
samente proporcional a la infección por
enterobacterias, con mayor número de ca-
sos a menores edades, no se ha encontrado
relación estadísticamente significativa en-
tre las E. coli resistentes y la variable edad.
Este dato resulta importante ya que podría
explicar, al menos parcialmente, la trans-
ferencia de cepas de E. coli portadoras de
resistencias o multirresistencias a la pobla-
ción infantil; o incluso un mal empleo de
las terapias antibióticas a cortas edades.
Los considerables porcentajes de resisten-
cia registrados, tanto por parte de entero-
bacterias como de E. coli en concreto, de
80
70
60
50
40
30
20
10
0
3 o más grupos menos de 3 grupos
Figura 2. Resistencia de E. coli a los distintos grupos de antibióticos
Edad
Resistentes
No resistentes
Total
< 24 meses
9
22
31
25-47 meses
9
10
19
48-71 meses
4
10
14
72-95 meses
3
8
11
> 96 meses
0
2
2
Total
25
52
77
Cuadro 4. Edad de los niños que mostraron E. Coli resistente
nuevo justificarían las teorías mencionadas. La amikacina
se muestra como la terapia más efectiva en todos los ca-
sos, mientras que el sulfatrimetoprim ha manifestado tales
porcentajes de resistencia que debería ser considerado como
tratamiento contraindicado para el tratamiento del SDA de
origen bacteriano en las poblaciones seleccionadas. Por úl-
timo, los valores porcentuales de resistencia microbiana ob-
tenidos para enterobacterias (entre 17,3% y 65,4%) y el caso
concreto de E. coli (entre 16,9% y 64,9%) son indicadores
del actual problema terapéutico al que nos enfrentamos, y
de un futuro poco prometedor en caso de que la tendencia
de aparición e incremento en las resistencias se mantenga en
los próximos años.
Agradecimientos
Los autores del presente artículo agradecen al Hospital
Pediátrico Alfonso Villagómez Román del cantón Rio-
bamba (Chimborazo, Ecuador) por el apoyo material y
humano para la ejecución del proyecto.

16
R
eferencias
1. Abraham EP, Chain E. 1988. An enzyme from bacteria able to destroy penicillin. 1940. Rev Infect
Dis. 10: 677–678.
2. Alekshun MN, Levy SB. 2007. Molecular Mechanisms of Antibacterial Multidrug Resistance.
Cell. 128: 1037–1050.
3. Davies J, Davies D. 2010. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev.
74: 417–433.
4. Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, et al. 2013. Antibiotic
resistance-the need for global solutions. Lancet Infect Dis. 13 (12): 1057–98.
5. Wellington EM, Boxall AB, Cross P, Feil EJ, Gaze WH, Hawkey PM et al. 2013. The role of the
natural environment in the emergence of antibiotic resistance in gram-negative bacteria. Lancet In-
fect Dis. 13 (2): 155-65.
6. World Health Organization. Antimicrobial resistance: global report on surveillance 2014; 2014.
7. Guerrant RL, Van Gilder T, Steiner TS, Thielman NM, Slutsker L, Tauxe RV, et al. 2001. Practice
Guidelines for the Management of Infectious Diarrhea. Clin Infect Dis. 32: 331–350.
8. Enríquez-Blanco H, Rodríguez JT, Schneider R. Síndrome de intestino irritable y otros trastornos
relacionados. México: Editorial Médica Panamericana; 2010.
9. Thapar N, Sanderson IR. 2004. Diarrhoea in children: an interface between developing and deve-
loped countries. Lancet. 363: 641–653.
10. Koletzko S, Osterrieder S. 2009. Acute Infectious Diarrhea in Children. Dtsch Arztebl Int. 106
(33): 539–548.
11. Bern C. Diarrhoeal diseases. En: Murray CJL, Lopez AD, Mathers CD (editors). The global epi-
demiology of infectious diseases. Genova, Suiza: Organización Mundial de la Salud; 2004.
12. Baldi F, Bianco MA, Nardone G, Pilotto A, Zamparo E. 2009. Focus on acute diarrhoeal Disease.
World J Gastroenterol. 15 (27): 3341-3348.
13. Vargas M, Gascon J, Casls C, Schellenberg D, Urassa H, Kahigwa E, et al. 2004. Etiology of
diarrhea in children less than five years of age in Ifakara, Tanzania. Am J Med Hyg. 70 (5): 536-539.
14. Diniz-Santos DR, Silva LR, Silva N. 2006. Antibiotics for the empirical treatment of acute infec-
tious diarrhea in children. Braz J Infect Dis. 10 (3): 217-27.
15. Thomas PD, Forbes A, Green J, Howdle P, Long R, Playford R, et al. 2003. Guidelines for the
investigation of chronic diarrhoea, 2nd edition. Gut. 52 (Suppl V): v1–v15.
16. Fariñas MC, Martínez-Martínez L. 2013. Infecciones causadas por bacterias gramnegativas mul-
tirresistentes: enterobacterias, Pseudomonas aeruginosa, Acinetobacter baumannii y otros bacilos
gramnegativos no fermentadores. Enferm Infecc Microbiol Clin. 31 (6): 402–409.
17. Díaz MA, Hernández-Bello JR, Rodríguez-Baño J, Martínez-Martínez L, Calvo J, Blanco J, et
al. 2010. Diversity of Escherichia coli Strains Producing Extended-Spectrum β-Lactamases in Spain:
Second Nationwide Study. J Clin Microbiol. 48 (8): 2840–2845.
18. García-Hernández AM, García-Vázquez E, Hernández-Torres A, Ruiz J, Yagüe G, Herrero JA,
et al. 2011. Bacteriemias por Escherichia coli productor de betalactamasas de espectro extendido
(BLEE): significación clínica y perspectivas actuales. Rev Esp Quimioter. 24 (2): 57-66.
19. Jafari F, Shokrzadeh L, Hamidian M, Salmanzadeh-Ahrabi S, Zali MR. 2008. Acute diarrhea due
to Enteropathogenic bacteria in patients at hospitals in Tehran Jpn J Infect Dis. 61: 269-273.
20. Pawlowski SW, Warren CA, Guerrant R. 2009. Diagnosis and Treatment of Acute or Persistent
Diarrhea. Gastroenterology. 136 (6): 1874–1886.
21. Guerrant RL, Van Gilder T, Steiner TS, Thielman NM, Slutsker L, Tauxe RV, et al. 2001. Practice
guidelines for the management of infectious diarrhea. Clin Infect Dis. 32: 331-351.
22. De la Rosa-Fraile M, Prieto-Prieto J. Microbiología en ciencias de la salud: conceptos y aplica-
ciones. Tercera edición. Madrid: Editorial Elsevier España; 2006.
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105

Toaquiza-Aguagallo, Mera-Balseca. Toasa-López, Morales-Yuste
17
23. Miranda-Candelario J, Huamaní-Egocheaga R, Ordóñez-Tanchiva K, Campos-Luyo M, Cam-
pos-Noriega C. 2011. Manejo de la enfermedad diarreica aguda en niños hospitalizados en el hospital
III Grau EsSalud. Acta Med Per. 28 (2): 146-149.
24. Molbak K, Jensen H, Ingholt L, Aaby P. 1997. Risk Factors for Diarrheal Disease Incidence in Early
Childhood: A Community Cohort Study from Guinea-Bissau. Am J Epidemiol. 146 (3): 273-282.
25. Giefing-Kröll C, Berger P, Lepperdinger G, Grubeck-Loebenstein B. 2015. How sex and age
affect immune responses, susceptibility to infections, and response to vaccination. Aging Cell. 14:
309-321.
26. DeWitt TG, Humphrey KF, McCarthy P. 1985. Clinical Predictors of Acute Bacterial Diarrhea in
Young Children. Pediatrics. 76 (4): 551 -556.
27. Klein EJ, Boster DR, Stapp JR, Wells JG, Qin X, Clausen CR, et al. 2006. Diarrhea Etiology in
a Children’s Hospital Emergency Department: A Prospective Cohort Study. Clin Infect Dis. 43: 807-
813.
28. Díaz-Mora JJ, Madera M, Pérez Y, García M, León K, Torres M. 2009. Segundo consenso sobre
enfermedad diarreica aguda en pediatría (parte 1). Generalidades en diarrea aguda. Arch Venez Puer
Ped. 72 (4): 139-145.
29. Larrosa-Haro A, Ruiz-Pérez M, Aguilar-Benavides S. 2002. Utilidad del estudio de las heces para
el diagnóstico y manejo de lactantes y preescolares con diarrea aguda. Sal Púb Méx. 44 (4): 328-334.
30. Lanata CF, Fischer-Walker CL, Olascoaga AC, Torres CX, Aryee MJ, Black RE. 2013. Global
Causes of Diarrheal Disease Mortality in Children <5 Years of Age: A Systematic Review. PLOS
ONE. 8 (9): 1-11.
31. Carpenter LR, Pont SJ, Cooper WO, Griffin MR, Dudley JA, Arbogast P, et al. 2008 Stool cultu-
res and antimicrobial prescriptions related to infectious diarrhea. J Infect Dis. 197: 1709-1712.
32. Yoginder K, Chitkara MD. 2005. Limited Value of Routine Stool Cultures in Patients Receiving
Antibiotic Therapy. Am J Clin Pathol. 123: 92-95.
33. Fajardo-Zapata AL, Méndez-Casallas FJ, Hernández-Niño JF, Molina LH, Tarazona AM, Nossa
C, et al. 2013. La automedicación de antibióticos: un problema de salud pública. Salud Uninorte.
Barranquilla (Col.). 29 (2): 226-235.
34. Notario R, Morales E, Carmelengo E, Borda N, Binsztein N, Depetris A, et al. 1993. Microrga-
nicmos enteropatógenos en niños con diarrea aguda en dos hospitales de Rosario, Argentina. Rev
Med. 53 (4): 289-299.
35. Miljković-Selimović B, Babić T, Stojanović P. 2010. Bacterial Etiology of Diarrheal Syndrome.
Scientific J Fac Med Niš. 27(2): 55-62.
36. Huovinen P. 2001. Resistance to Trimethoprim-Sulfamethoxazole. Clin Infect Dis. 32: 1608-
1614.
37. Paniagua-Contreras GL, Monroy-Pérez E, Vaca-Pacheco S. 2007. Fenotipos de resistencia a
antibióticos en cepas de Escherichia coli diarreogénicas detectadas en infantes mediante reacción en
cadena de la polimerasa multiplex. Rev Med Hosp Gen Mex. 70 (4): 158-167.
38. Salles MJC, Zurita J, Mejía C, Villegas MV. 2013. Resistant Gram-negative infections in the
outpatient setting in Latin America. Review Article. Epidemiol Infect. 141: 2459–2472.
39. Rodríguez-Baño J, Cisneros JM, Cobos-Trigueros N, Fresco G, Navarro-San Francisco C, Gu-
diol C, et al. 2015. Diagnosis and antimicrobial treatment of invasive infections due to multidrug-re-
sistant Enterobacteriaceae. Guidelines of the Spanish Society of Infectious Diseases and Clinical
Microbiology. Enferm Infecc Microbiol Clin. 33 (5): 337.e1-337.e21.
40. Daza-Pérez RM. 1998. Resistencia bacteriana a antimicrobianos: su importancia en la toma de
decisiones en la práctica diaria. Información Terapéutica del Sistema Nacional de Salud. 22 (3): 57-67.
41. Nikaido H. 2009. Multidrug Resistance in Bacteria. Annu Rev Biochem. 78: 119-146.
42. Bustos E (editor). 1995. Tranferencia plasmidial de multirresistencia en cepas enteropatógenas de
Escherichia coli serotipo 0111. Revista Chilena de Pediatría: 445-449.