
18
COMPARACIÓN DE FLUOROCROMOS PARA EL RECUENTO
DIRECTO DE MICROORGANISMOS TOTALES POR MICROSCOPÍA
DE EPIFLUORESCENCIA EN AGUAS MINEROMEDICINALES
1,2
Félix Andueza,
2
Judith Araque,
2
María Gutiérrez,
2
Carlos Rodríguez,
1,2
Gerardo Medina,
3
Carmen de la Rosa,
3
Ángeles Mosso.
1
Escuela de Bioquímica y Farmacia. Facultad de Ciencias. Escuela Superior
Politécnica del Chimborazo (ESPOCH). Riobamba. Ecuador.
2
Laboratorio de Microbiología del Agua. Facultad de Farmacia y Bioanálisis.
Universidad de los Andes. Mérida, Venezuela.
3
Facultad de Farmacia Universidad Complutense de Madrid. España.
anduezaf@ula.ve; felix.andueza@espoch.edu.ec
R
esumen
La microscopia de fluorescencia con el colorante naranja de acridina ha sido el método estándar para de-
terminar la población microbiana en muestras de aguas por varias décadas. Sin embargo, se ha cuestiona-
do su utilidad (1). En este sentido, se plantea un trabajo cuyo objetivo ha sido comparar el colorante naran-
ja de acridina respecto a los colorantes Syto 9 y yoduro de propidium contenidos en el Kit LIVE/DEAD
BacLight, en la cuantificación del número total de microorganismos presentes en muestras de aguas mi-
neromedicinales, por métodos de epifluorescencia. Se analizó un total de 50 muestras. El recuento de
microorganismos totales se realizó por la técnica de recuento directo con microscopio de epifluorescencia
utilizando los colorantes naranja de acridina, Syto 9 y yoduro de propidio, respectivamente (2, 3). El dise-
ño propuesto para la comparación estadística de los métodos estudiados fue el de protocolo acoplado. La
correlación entre las dos variables estudiadas se calculó por el método de Pearson utilizando el programa
estadístico Microsoft Excel 2010. Los análisis de regresión para el recuento de microorganismos totales
mostraron un coeficiente de correlación de 0,86 y una pendiente de 1,02, indicando una buena correlación
entre las metodologías. El colorante naranja de acridina arrojó valores más elevados de microorganismos
totales que los observados con los colorantes Syto 9 y yoduro de propidium.
Palabras claves: fluorocromos, microorganismos, epifluorescencia, agua mineromedicinal
A
bstract
Fluorescence microscopy with acridine orange dye has been the standard method for determining the
microbial population in samples of water for several decades. However, their usefulness has been ques-
tioned (1). In this sense, there is a work whose purpose was to compare the dye acridine orange, with
SYTO 9 and propidium iodide dyes, in the quantification of the total number of microorganisms present
in samples of spring waters by means of epifluorescence. We analyzed a total of 50 samples. The total
count of microorganisms was performed by the technique of direct counting with epifluorescence mi-
croscopy using acridine orange, Syto 9 and propidium iodide, respectively (2,3). The proposed design
for the statistical comparison of the methods studied was the protocol attached. The correlation between
two variables was calculated by the method of using the Pearson statistical program Microsoft Excel
2010. The regression analysis for enumeration of microorganisms showed total correlation coefficients
of 0.86 and a slope of 1.02 indicating a good correlation between the methodologies. The dye acridine
orange gave higher total microorganisms that observed with the SYTO 9 dyes and propidium iodide
Keywords: fluorochromes, microorganism, epifluorescence, spring water

19
INTRODUCCIÓN
El contaje directo por epifluorescencia ha
sido descrito como un método útil para la
enumeración de bacterias totales en mues-
tras medioambientales. El número de bac-
terias presentes en un ambiente o producto
determinado se ha estudiado generalmente
utilizando el contaje en placa, con medios
de cultivos apropiados. Sin embargo, se
han asociado algunas desventajas con esta
metodología, tales como el tiempo que
consume su realización, la distribución de
los microorganismos en los productos, las
asociaciones que pueden formar las bac-
terias tales como cadenas o cúmulos y el
hecho de que solo se recupera un 10% de
la población presente (4, 5). Una aproxi-
mación más directa la constituye el uso de
las técnicas microscópicas, sin embargo
requieren la diferenciación entre la mate-
ria inerte y entre bacterias vivas y muertas.
El contaje directo por epifluorescencia ha
sido descrito como un método útil para
la enumeración del número de bacterias
totales en muestras medioambientales (6,
7). La microscopia de fluorescencia con
el colorante 3,6-bis-dimetil-amino cloruro
de acridina (naranja de acridina) ha sido el
método estándar para determinar la pobla-
ción bacteriana en muestras de aguas por
varias décadas (6, 8). Sin embargo, diver-
sos investigadores han cuestionado su ha-
bilidad para distinguir entre lo inanimado
y lo vivo, lo que ha llevado a pensar en
una sobrestimación de la población bac-
teriana presente en diversas comunidades
acuáticas (1, 9). En los últimos años, se ha
venido utilizando el kit de viabilidad bacte-
riana LIVE/DEAD BacLight que permite
diferenciar entre bacterias vivas y muertas
basándose en la integridad de la membrana
plasmática bacteriana. El kit está compues-
to de dos colorantes fluorescentes que ac-
túan sobre los ácidos nucleicos, el Syto 9 y
el yoduro de propidium. El colorante Syto
9 penetra tanto bacterias viables como no
viables, mientras que el yoduro de propi-
dium penetra solo en bacterias con daños
en la membrana plasmática, eliminando la
fluorescencia verde del Syto 9. De esta manera, las bacte-
rias con daños en la membrana toman una coloración roja
fluorescente y las que no presentan daño, una coloración
verde (1, 2). Tomando en consideración lo antes señalado
en este estudio, se ha comparado los fluorocromos conte-
nidos en el kit de viabilidad bacteriana LIVE/DEAD Ba-
cLight respecto al colorante naranja de acridina para enu-
merar el total de bacterias presentes en muestras de aguas
mineromedicinales
MATERIALES Y MÉTODOS
A. MATERIALES
A.1. estras
Se tomaron muestras de agua mineromedicinal en los pun-
tos de emergencia de cinco manantiales de agua minero-
medicinales, ubicados en la región de Jaraba, Zaragoza,
España (San Vicente, San Luis, La Peña, Pilas y San José).
Se realizaron cinco muestreos en cada uno de los sitios
antes señalados. En cada ocasión, se tomaron dos mues-
tras de agua de 1,5 litros, recogidas en recipientes esté-
riles de plástico, los cuales se trasladaron a temperatura
ambiente y en la oscuridad al laboratorio, realizándose
los análisis microbiológicos antes de las 24 horas.
Simultáneamente, de cada una de las muestras recolecta-
das, se tomaron 200 ml y se trasvasaron a un recipiente
de plástico estéril, añadiendo 2 ml de formol al 4% para
fijar e inhibir el crecimiento bacteriano, y poder determi-
nar en el laboratorio el contenido total microbiano.
B.
METODOLOGÍA
B.1. Recuento de microorganismos totales y vivos
El recuento de microorganismos totales se realizó por la
técnica de recuento directo con microscopio de epifluores-
cencia (8), siguiendo dos métodos y utilizando los colo-
rantes naranja de acridina, y Syto 9 y yoduro de propidio.
En el primer caso, las muestras se tiñeron con el colorante
fluorescente naranja de acridina (0,1%) durante cinco minu-
tos, a razón de 1 ml de colorante por 10 ml de agua. Transcu-
rrido el tiempo, se filtraron al menos 2 ml a través de filtros
Nucleopore (Millipore) de 0,20 µm de diámetro de poro y
de 25 mm de diámetro, y se lavaron con agua estéril. Se de-
positó el filtro en un portaobjetos, se añadió encima del filtro
una gota de aceite de vaselina y se colocó un cubreobjetos.
Se examinó con microscopio de epifluorescencia (Nikon)
con objetivo de inmersión, utilizando aceite de inmersión no
fluorescente. Para aumentar el contraste y evitar la autofluo-
rescencia, se tiñeron los filtros durante varias horas con un
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105

Andueza, Araque, Gutiérrez, Rodríguez, Medina, De la Rosa, Mosso
20
colorante negro Irgalan Black (Merck) en solución al 0,2%
en ácido acético al 2% y se lavaron dos veces con agua des-
tilada estéril. La coloración de las bacterias metabólicamente
activas es roja; las inactivas pero vivas, verdes, y las muertas
y partículas inertes, color naranja. Para realizar el recuento
se contaron los microorganismos presentes en 25 campos del
microscopio elegidos al azar. Se calculó la media aritmética
que se multiplicó por un factor que incluye el número de cam-
pos del filtro y el volumen de agua. El resultado se expresó
como número de microorganismos por ml de agua.
En el segundo método, las muestras de agua se tiñeron durante
15 minutos con el kit de viabilidad bacteriana BacLight Live/
Dead (Molecular Probes, Eugenes, OR, USA), el cual deter-
mina la integridad de la membrana bacteriana, a través de la
exclusión selectiva de la tinción (2). El kit está compuesto de
dos colorantes afines a los ácidos nucleicos: Syto 9 y yoduro
de propidio. El Syto 9 colorea todas las células de verde, y el
yoduro de propidio penetra en las células que tengan dañada
su membrana, tiñéndolas de rojo (10). La muestra teñida se
filtró como en el método anterior, a través de un filtro Nu-
cleopore de 0,2 µm y se observó con objetivo de inmersión
en un microscopio de epifluorescencia (Nikon). Seguidamen-
te se cuantificó el número de células verdes (vivas) y rojas
(muertas) presentes, en por lo menos 10 campos, y se calculó
el número de microorganismos por mililitro de muestra (3).
B.2. Análisis estadísticos
El diseño propuesto para la comparación estadística de
los métodos estudiados fue el de protocolo acoplado. La
correlación entre las dos variables estudiadas se calculó
por el método de Pearson utilizando el programa estadís-
tico Microsoft Excel 2010.
RESULTADOS
Los resultados promedio obtenidos en el contaje de bac-
terias totales utilizando el colorante naranja de acridina
se exhiben en la cuadro 1, y los obtenidos con los colo-
rante Syto 9 e yoduro de propidium en la cuadro 2.
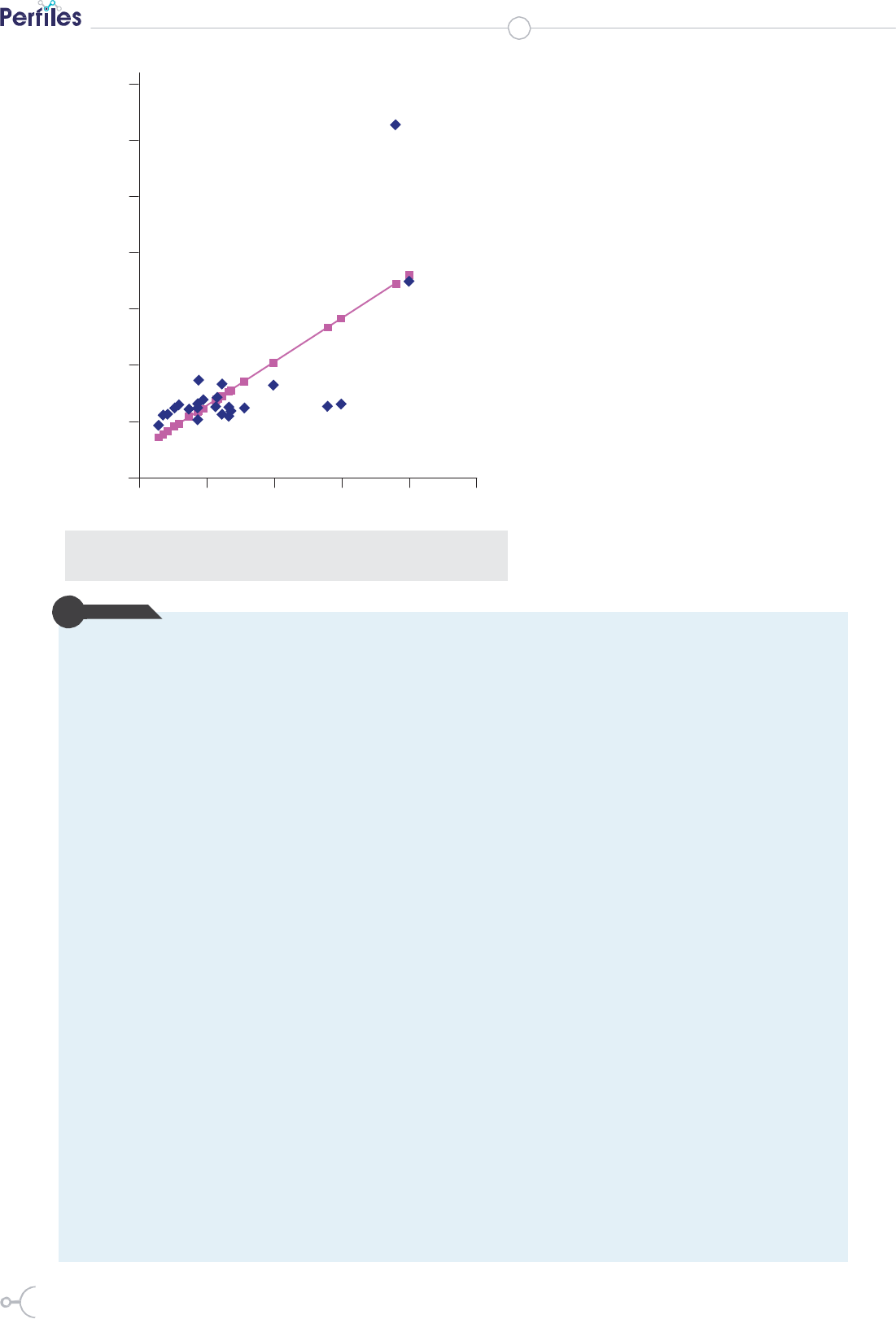
Los resultados obtenidos en el análisis de regresión, así
como la curva de regresión obtenida, al comparar los valo-
res promedios obtenidos en el recuento de bacterias totales
utilizando el colorante naranja de acridina respecto a los va-
lores promedios obtenidos utilizando los colorantes Syto 9 e
yoduro de propidium se muestran en el cuadro 3 y figura 1.
DISCUSIÓN
Varios fluorocromos se han utilizado para determinar el nú-
mero total de bacterias en muestras ambientales. El naranja
de acridina ha sido ampliamente utilizado y
basa su acción en su interacción con los áci-
dos nucleicos. Cuando la concentración del
fluorocromo se mantiene baja, las bacterias
crecen con fluorescencia rojo verdosa, de-
bido al predominio del ARN; mientras que
las bacterias inactivas, donde predomina el
ADN, se observan con una fluorescencia
verde. Sin embargo, se han reportado cier-
tas fallas en el contaje directo por epifluo-
rescencia con naranja de acridina, debido a
factores tales como la tasa ARN/ADN en
el interior de la bacteria, la concentración
del colorante, el contenido de partículas in-
animadas en la muestra, medio de cultivo
empleado y la taxonomía bacteriana (8, 11).
En los últimos años, se ha venido utilizando
el kit de viabilidad bacteriana LIVE/DEAD
BacLight, que permite diferenciar entre
bacterias vivas y muertas basándose en la
integridad de la membrana plasmática bac-
teriana. El colorante Syto 9 penetra tanto
bacterias viables como no viables, mientras
que el yoduro de propidio penetra solo bac-
terias con daños en la membrana plasmá-
tica, eliminando la fluorescencia verde del
Syto 9. De esta manera, las bacterias con
daño en la membrana toman una colora-
ción roja fluorescente y las que no presen-
tan daño, una coloración verde (2, 3).
En los cuadros 1 y 2, se resumen los valo-
res promedios obtenidos en el contaje del
número total de microorganismos presen-
tes en las aguas minerales naturales anali-
zadas, utilizando los fluorocromos naran-
ja de acridina y los contenidos en el kit de
viabilidad bacteriana LIVE/DEAD.
Del análisis de los datos antes señala-
dos, se puede observar que con el fluo-
rocromo naranja de acridina se obtienen
valores promedios comprendidos entre
1,4 x 10
4
y 2,0 x 10
5
microorganismos
por mililitro (cuadro 1) y con el kit de
viabilidad LIVE/DEAD, valores prome-
dios entre 0,4 x 10
4
y 1,5 x 10
5
microor-
ganismos por mililitro (cuadro 2). Estos
valores son muy similares y reflejan una
buena correspondencia entre los fluoro-
cromos analizados, a pesar de que, en
forma general, los valores obtenidos con

21
el fluorocromo naranja de acridina son
ligeramente superiores a los obtenidos
con el kit de viabilidad LIVE/DEAD.
Se ha señalado que el kit de viabilidad
bacteriana LIVE/DEAD da sistemática-
mente bajos contajes y correlaciones no
ajustadas, aunque significativas, cuando
se comparan con otros métodos o fluoro-
cromos (12). El protocolo que se emplea
para la aplicación del kit implica una doble
tinción, donde un fluorocromo remplaza a
otro por competencia, lo que podría afec-
tar su eficacia y su fiabilidad (2). Sin em-
bargo, en el presente trabajo se obtuvo va-
lores en el mismo orden de magnitud con
el kit viabilidad bacteriana LIVE/DEAD y
el colorante naranja de acridina.
Todo lo señalado anteriormente podría
explicar el mayor número de microorga-
nismos que se detectan con el fluorocro-
mo naranja de acridina en las muestras de
agua mineral natural.
En el cuadro 3 y figura 1, se resumen los re-
sultados del análisis de regresión, para com-
parar los fluorocromos naranja de acridina y
los integrantes del kit de viabilidad bacteria-
na LIVE/DEAD, en su habilidad para deter-
minar el número de microorganismos pre-
sentes en muestras de agua mineral natural.
Tanto los valores del coeficiente de corre-
lación (0,86) como la pendiente (1,02) y la
intercepción con el eje x (-0,33), eviden-
cian una buena correspondencia entre los
fluorocromos para determinar el número
total de microorganismos presentes en
muestras de agua mineral natural.
La utilización del kit de viabilidad bacteria-
na LIVE/DEAD, para la determinación del
número total de microorganismos presentes
en el agua mineromedicinal, además de re-
sultar equiparable al de naranja de acridina,
presenta la ventaja de ser más práctico y rá-
pido en su empleo, además de ser mucho
más seguro, desde un punto de vista de la
toxicidad para el usuario.
CONCLUSIONES
Los resultados obtenidos permiten señalar que
los fluorocromos estudiados dan resultados
Manantial
1
(N.º/ml)
2
(N.º/ml)
3
(N.º/ml)
4
(N.º/ml)
5
(N.º/ml)
S. Vicente
4,4 x10
4
6,1x10
4
2,9x10
4
3,7x10
4
9,9x10
4
S. Luis
1,4x10
4
1,4x10
5
5,6x10
4
6,6x10
4
4,7x10
4
La Peña
4,3x10
4
2,1x10
4
4,3x10
4
5,7x10
4
1,5x10
5
Pilas
1,9x10
5
7,8x10
4
4,3x10
4
6,1x10
4
6,8x10
4
S. José
2,0x10
5
1,8x10
4
5,8x10
4
6,6x10
4
2,6x10
4
Cuadro 1. Número promedio de microorganismos totales en aguas minero-
medicinales de acuerdo con la técnica de coloración con naranja de acridina.
Manantial
1
(N.º/ml)
2
(N.º/ml)
3
(N.º/ml)
4
(N.º/ml)
5
(N.º/ml)
S. Vicente
5,0x10
4
4,6x10
4
2,6x10
4
2,0x10
4
4,5x10
4
S. Luis
0,4x10
4
2,4x10
4
2,2x10
4
1,3x10
4
3,0x10
4
La Peña
1,0x10
4
1,6x10
4
2,6x10
4
2,4x10
4
2,6x10
4
Pilas
3,1x10
5
2,1x10
4
2,1x10
4
1,5x10
4
1,9x10
4
S. José
1,5x10
5
1,4x10
4
3,3x10
4
2,2x10
4
2,2x10
4
Cuadro 2. Número promedio de microorganismos totales
en aguas mineromedicinales de acuerdo con la técnica de coloración
con Syto 9 y yoduro de propidio (kit BacLight)
Parámetro
Fluorocromos
Naranja de acridina
(N.º/ml)
Kit BacLight LIVE/DEAD
(N.º/ml)
A. Análisis de datos
Valor mínimo
14.000,00
4.000,00
Valor máximo
200.000,00
150.000,00
Media
53.760,00
33.880,00
Desviación estándar
48.365,17
36.800,49
Nivel de confianza (95%)
B. Análisis de regresión
Coeficiente de correlación
0,86
Pendiente
1,02
Intercepción eje X
-0,33
Error típico
0.19
Cuadro 3. Valores estadísticos para los recuentos de microorganismos
totales en aguas mineromedicinales obtenidos con los fluorocromos
naranja de acridina y con el kit BacLight
muy similares en la cuantificación del número de microorga-
nismos totales presentes en muestras de agua mineral natural,
aunque el colorante naranja de acridina presenta valores supe-
riores a los obtenidos con el kit de viabilidad bacteriana.
La sencillez, rapidez y seguridad en la aplicación del kit
de viabilidad bacteriana LIVE/DEAD y la eficacia de sus
fluorocromos hacen que sea una opción válida y ventajo-
sa para la determinación del número total de microorga-
nismos en muestras de aguas mineromedicinales, donde
se requiere saber la presencia del número de células vi-
vas, de manera rápida y precisa.
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105
22
Número
de
bacterias
totales
con
Syto
9
(células/ml
)
350 000
300 000
250 000
200 000
150 000
100 000
50 000
0
0 50 000 100 000 150 000 200 000 250 000
A la Universidad Complutense de Madrid,
España, a través del grupo de investigación
de aguas mineromedicinales del Departa-
mento de Microbiología II de la Facultad
de Farmacia, por las facilidades, el apoyo
económico y la asesoría para el desarrollo
experimental del presente trabajo.
Al Consejo de Desarrollo Científico, Tec-
nológico, Humanístico y Artístico de la
Universidad de los Andes (CDCHTA), por
el financiamiento para parte del presente
trabajo, a través del proyecto FA-432-A.
De igual forma, al Ministerio de Ciencias
y Tecnología de Venezuela, por parte del
financiamiento brindado a través del pro-
yecto del Observatorio Nacional de Cien-
Número de bacterias totales con naranja de acridina (células/ml)
Figura 1. Curva de regresión. Recuento de bacterias totales en aguas mineromedi-
cinales utilizando el colorante naranja de acridina, Syto 9 y yoduro de propidium
R
eferencias
cia, Tecnología e Innovación del Ministe-
rio de Ciencia y Tecnología de Venezuela,
sobre microbiota de las aguas termales.
1. Defives C, Guyard S, Oulare MM, Mary P, Hornez JP. 1999. Total counts, culturable and viable, and
non-culturable microflora of a French mineral water: A case study. J. Appl. Microbiol. 86: 1033-1038.
2. Haugland RP. 1996. Handbook of fluorescent probes and research chemicals. Molecular Probes
Inc., Eugene, Oreg.
3. Boulos L, Prévost M, Barbeau B, Coallier J, Desjardins R. 1999. LIVE/DEAD BacLight: appli-
cation of a new rapid staining method for direct enumeration of viable and total bacteria in drinking
water. J Microbiol Methods. 37: 77-86.
4. Leclerc H, Moreau A. 2002. Microbiological safety of natural mineral water. FEMS Microbiol
Rev. 26: 207-222.
5. Senjarini K, Karsten U, Schumann R. 2013. Application of Fluorscense markes for the diagnosis of
bacterial abundance and viability in aquatic ecosystem. J Microbiol Res. 3 (4): 143-147
6. Kepner RJ, Pratt JR. 1994. Use of fluorochromes for direct enumeration of total bacteria in envi-
ronmental samples: past and present. Microbiol Rev. 58: 603-615.
7. Nocker A, Richter-Hatmann T, Montijin R, Schureu F, Kort R. 2010. Discrimination between live
and dead cells in bacterial communities from environmental water samples analysed by 454 pyrose-
quencing. Int Microbiol. 13: 59-65.
8. Hobbie JE, Daley RJ, Jasper S. 1977. Use of Nuclepore filters for counting bacteria by fluorescen-
ce microscopy. Appl Environ Microbiol. 33: 1225-1228.
9. Stiefel P, Schmidt S, Manura K, Ren Q. 2015. Critical aspects of using bacterial cell viability as-
says with the fluorophores SYTO-9 and propidium iodide. BMC Microbiology. 15: 2-9.
10. Ramalho R, Cunha J, Teixeira P, Gibbs P. 2001. Improved methods for the enumeration of hete-
rotrophic bacteria in bottled mineral waters. J Microbiol Methods. 44: 97-103.
11. McFebers G, Singh A, Byun S, Callis P, Williams S. 1991. Acridine orange staining reaction as
an idex of physiological activity in Escherichia coli. J Microbiol Methods. 13: 87-97.
12. Gasol JM, Zweifel UL, Peters F, Fuhrman JA, HagstromA. 1999. Significance of size and nucleic acid content
heterogeneity as measured by flow cytometry in natural planktonic bacteria.Appl Environ Microbiol. 10:4475-83.
AGRADECIMIENTOS
ISSN 1390-5740 Número 14 Vol. 2 (2015)
ISSN 2477-9105