
COMPARACIÓN
INTERLABORATORIOS
DE
PARÁMETROS
CLÍNICOS RELACIONADOS CON EL DIAGNÓSTICO
DE
DIABETES EN LA
PROVINCIA
DE
CHIMBORAZO
J. Idrovo-Novillo
1
*, I. Gavilanes-Terán
1
.
Facultad de Ciencias, Escuela Superior Politécnica de Chimborazo
1
,
EC060155-Riobamba (Chimborazo), Ecuador
*e-mail: julio.idrovo@espoch.edu.ec; Telephone: 03-2601331
R
esumen
A
bstract
4
Diabetes is a disease that affects the population and whose prevalence levels are rising, mainly
related to metabolic disorders of glucose, triglycerides and total cholesterol. Early detection through
clinical analysis contributes to the prevention of diseases, so confidence in the results is essential
for the diagnosis of the disease. In this paper, the results of cholesterol, glucose and triglyceride
levels, which have been obtained in 4 different laboratories in the province of Chimborazo by the
spectrophotometric method in blood samples from 61 young volunteers of both sexes between 19
and 22 years, were compared. The results of cholesterol and glucose were significantly different
at the 5% level. The concordance of results of cholesterol, glucose and triglycerides were 85.2%,
91.8% and 86.9%, respectively. Finally, the inconsistencies in results can lead to wrong analysis by
physicians who rely on clinical diagnostic tests.
Key words: glucose, clinical laboratory, cholesterol; triglycerides, ANOVA
La diabetes es una enfermedad que afecta a la población con niveles de prevalencia en aumento,
asociada principalmente a trastornos metabólicos de glucosa, triglicéridos y colesterol total. Su
detección temprana a través de los análisis clínicos coadyuva a la prevención de los problemas de la
salud, por lo que la confianza en sus resultados es fundamental para el diagnóstico de la enfermedad.
En este trabajo, se compararon los resultados de colesterol, glucosa y triglicéridos obtenidos en 4
diferentes laboratorios de la provincia de Chimborazo mediante el método espectrofotométrico, en
61 muestras sanguíneas de jóvenes voluntarios de ambos sexos entre 19 y 22 años. Los resultados de
colesterol y glucosa fueron significativamente diferentes al nivel del 5%. Las concordancias de los
resultados de colesterol, glucosa y triglicéridos fueron del 85,2%, 91,8% y 86,9%, respectivamente.
Las inconsistencias de los resultados pueden conducir a un diagnóstico equivocado por parte de los
médicos que se apoyan en las pruebas clínicas.
Palabras clave: glucosa, laboratorio clínico, colesterol, triglicéridos, ANOVA
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Idrovo-Novillo, Gavilanes-Terán
Introducción
importante que permite a los profesionales en salud,
diagnosticar y controlar a los pacientes, pero cuando se
utilizan inadecuadamente en cualquier etapa del proceso
de pruebas (análisis previo, durante el análisis o post
análisis), las pruebas de laboratorio pueden producir
resultados erróneos que ponen en peligro la salud y
seguridad del paciente (7).
En
Ecuador,
la
diabetes
es una
enfermedad endócrino metabólica que
afecta a la población con tasas cada
vez más elevadas. Según la encuesta
ENSANUT-ECU (1), la prevalencia de
diabetes en la población de 10 a 59 años
es de 1.7%. Entre los principales factores
de riesgo se encuentra el sobrepeso y la
obesidad, observándose en los últimos
20 años un aumento de la prevalencia de
obesidad entre niños y adolescentes (2).
El sobrepeso y obesidad en la población
adolecentes entre 12 a 19 años es del
26,0% y entre los 20 > 60 años de
62,8% (3). La diabetes se halla asociada
a trastornos metabólicos vinculados
al metabolismo de la glucosa, de los
triglicéridos (TAG), y colesterol total,
entre otros parámetros, por lo que su
detección temprana a través del análisis
clínico de los principales metabolitos
Se han realizado varios estudios a nivel internacional
con la finalidad de comparar los resultados clínicos entre
diferentes laboratorios. Se ha comparado la precisión
diagnóstica de pruebas sanguíneas incluida la medición
de los niveles de colesterol total para la evaluación
de la fibrosis hepática, frente a la biopsia hepática, en
pacientes no tratados con hepatitis crónica tipo C (8).
Se ha estudiado la concordancia que deben tener los
resultados entre laboratorios clínicos para la toma de
decisiones analizando entre varios parámetros clínicos,
el colesterol total y los niveles de TAG, obteniéndose una
concordancia entre el 85 al 89% de los resultados (9).
Se han realizado estudios sobre la supervisión de
concentraciones sanguíneas de iones metálicos en casos
de pacientes con implantes de metal en la cadera, donde
se ha evaluado la reproducibilidad de los valores de los
niveles de iones metálicos en diferentes laboratorios,
y los resultados han sido concluyentes al indicar que
existen diferencias significativas entre laboratorios,
debido a las diferentes tecnologías utilizadas para sus
mediciones (10). Ha sido estudiada la reproducibilidad de
los resultados en la medición de glucosa sanguínea para
la detección de la diabetes y su relevancia fisiopatológica
en individuos sanos y diabéticos (11).
involucrados,
es
importante
como
medida de prevención en salud.
Por lo tanto, la fiabilidad de las pruebas
biológicas en nuestro país, es un tema
importante para el cuidado del paciente
en términos de salud pública y que
implica altos riesgos económicos. En
consecuencia, las mediciones clínicas
deben ser fiables y comparables para
garantizar una gestión
eficaz
del paciente
(4). Entre el 60% a 70% de las decisiones
médicas se basan en los resultados de
las pruebas de diagnóstico in vitro (5),
y los resultados dependen en su mayor
parte del tipo de método utilizado para
el análisis y muchas veces pueden no
ser comparables entre los laboratorios
clínicos.
Se han estudiado los errores comunes encontrados
durante el proceso de análisis de pruebas de laboratorio
y se han examinado varias prácticas establecidas que
ayudan a maximizar los
beneficios
de los resultados de las
pruebas de laboratorio clínico (7). Sin embargo, no existe
suficiente
evidencia
científica
en el país, que, indique que
los resultados obtenidos en los diferentes laboratorios
clínicos son iguales o que por lo menos guardan
concordancia entre sí a pesar de que han sido realizados
con la misma técnica de análisis. Por lo que el objetivo
de este trabajo, fue realizar un estudio comparativo entre
los resultados obtenidos de los principales marcadores de
la diabetes: glucosa, TAG y colesterol total en diferentes
laboratorios de la provincia.
Los datos no fiables desde el punto
de vista económico, conducen a la
repetición
innecesaria de
ensayos
que generan gastos de salud pública
evitables (6). Cuando son utilizadas
correctamente, las pruebas de laboratorio
ofrecen
críticamente
información
La calidad de una medida depende tanto de su validez
5

como de su fiabilidad, que indica hasta qué punto se
obtienen los mismos valores medidos en más de una
ocasión, bajo condiciones similares (12). La concordancia
entre variables es muy importante en la práctica clínica y
es afectada tanto por la variabilidad de los observadores
como por la variabilidad del instrumento de medida o
por el propio proceso a medir (12). La sustitución de una
antigua técnica de medida requiere que la nueva técnica
concuerde suficientemente (13, 14). A menudo se analiza
utilizando coeficientes de correlación, pero puede ser
engañoso (14), debido a que el concepto de correlación
lineal no es igual al de concordancia (15). Altman and
Bland (13) proponen un gráfico sencillo para evaluar la
concordancia entre dos métodos de medida, en el cual
se representa la diferencia entre cada pareja de valores
frente a su media (13-15). Para cuantificar la fiabilidad
de las mediciones de variables cuantitativas continuas,
se usa el coeficiente de correlación intraclase que estima
el promedio de las correlaciones entre todos los pares de
observaciones (12, 16)
Todos los análisis y gráficos estadísticos
se llevaron a cabo utilizando IBM®
SPSS® Statistics 22.
Resultados y Discusión
Los
triglicéridos
presentan
mayor
variabilidad con valores de desviación
estándar relativa (d.e.r.) entre 0,387
y 0,777; mientras que la menor
variabilidad se observa en los valores de
glucosa 0,055≤ d.e.r.≤ 0,089. En general,
el laboratorio 1 muestra los resultados
más homogéneos y el laboratorio 3 los
menos homogéneos. De igual forma,
los resultados de glucosa (0,090) y
triglicéridos (0,0718) son más variables
en hombres, en tanto que los resultados
de colesterol (0,196) son más variables
en mujeres (Tabla 1).
Procedimiento experimental
La Tabla 2 muestra que los laboratorios
1 y 4 obtuvieron valores similares
de colesterol pero significativamente
diferentes de los resultados de los
laboratorios 2 y 4. Los valores de glucosa
son similares para los laboratorios 1
y 3 y 2, 3 pero muy diferentes de los
valores encontrados en el laboratorio 4.
Los valores medios de triglicéridos son
similares para todos los laboratorios.
A 61 voluntarios en ayunas (46 mujeres y 15 hombres)
con edades comprendidas entre 19 y 22 años, se les
extrajo una muestra de sangre que fue inmediatamente
dividida en cuatro tubos, llevándose de inmediato cada
uno de ellos a los diferentes laboratorios seleccionados
para el análisis de colesterol, glucosa y triglicéridos.
Materiales y Métodos
En las muestras sanguíneas se realizaron los análisis de
colesterol, glucosa y triglicéridos mediante el método
espectrofotométrico en cuatro diferentes laboratorios
clínicos. Se realiza un análisis descriptivo para hombres
y mujeres. Las medias se compararon utilizando ANOVA
de un factor (LABORATORIO) previa verificación de
los supuestos de homocedasticidad y de normalidad.
La determinación de los subconjuntos homogéneos se
realizó a través de la mínima diferencia significativa
(DMS). Con los valores de los parámetros clínicos se
realizó la correlación lineal, se adaptó el análisis de
Bland-Altman para comparación interlaboratorios y se
determinó el coeficiente de correlación intraclase. Para
determinar la concordancia se calcularon las frecuencias
y porcentajes de los resultados clínicos dentro y fuera
del rango referencial (9). Las coincidencias son las
situaciones en las cuales todos los cuatro laboratorios
obtuvieron los resultados dentro o fuera del rango normal.
El análisis de correlación lineal muestra
que, para cada parámetro clínico
estudiado, todos los pares de laboratorios
están
significativamente
correlacionados
con p < 0,01 (Tabla 3), lo cual se puede
apreciar en la Figura 1.
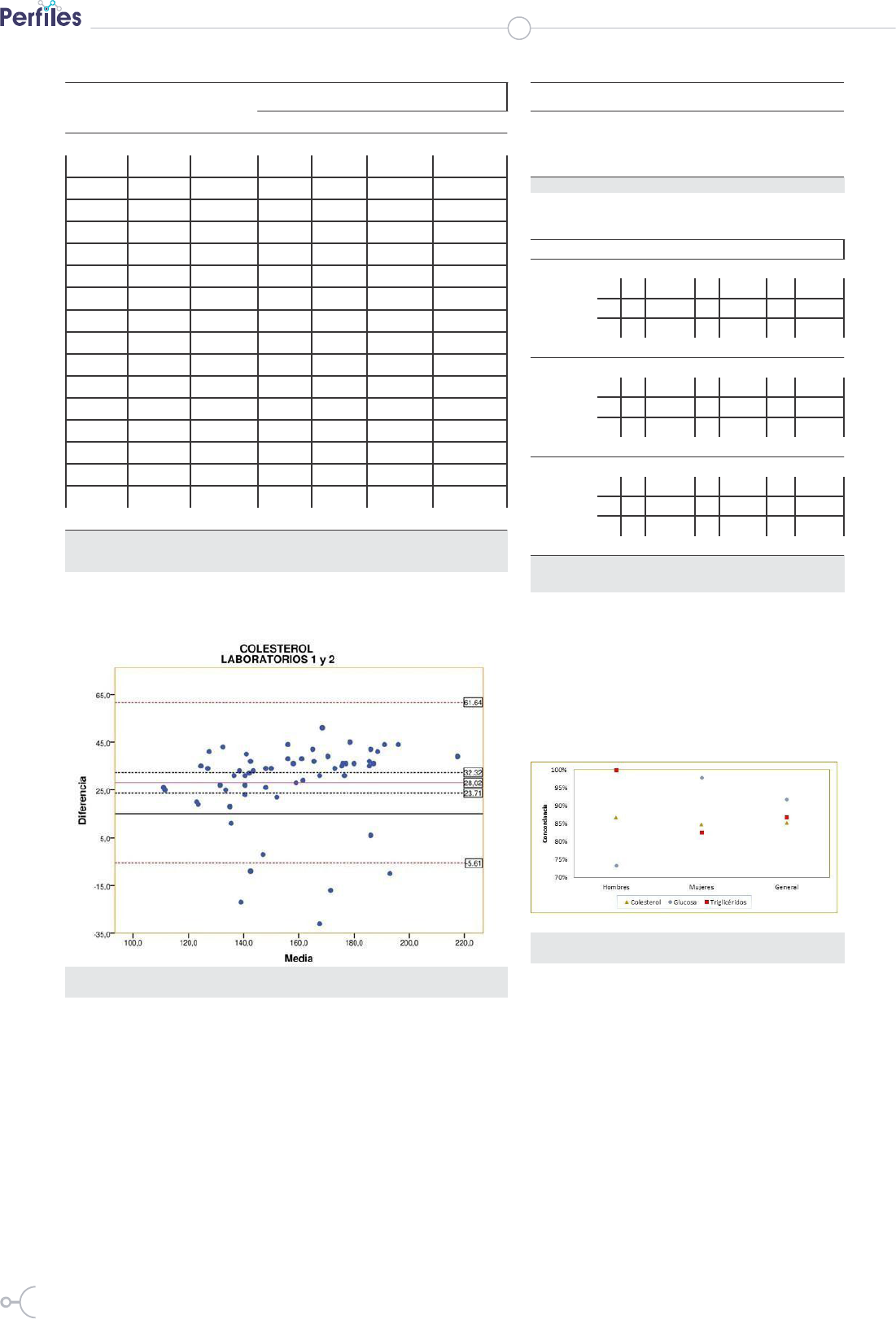
En la tabla 4 se pueden observar los
límites de concordancia obtenidos por el
método de Bland-Altman. Los resultados
de glucosa son los que presentan límites
de concordancia más bajos, pero en
general los intervalos son muy amplios,
denotando falta de concordancia de las
medidas interlaboratorios.
La tabla 5 muestra los valores del co-
eficiente de correlación intraclase. De
6
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Idrovo-Novillo, Gavilanes-Terán
d.e.r.: desviación estándar relativa
acuerdo con la tabla de valoración de
la concordancia según los valores del
Coeficiente de Correlación Intraclase
(CCI) (12), se considera que existe muy
buena concordancia en los triglicéridos
(CCI>0,90), y buena concordancia en
colesterol y glucosa (0,71<CCI<0,90).
En la tabla 6 se observa el número de laboratorios que
presentan valores fuera del rango normal para un mismo
individuo. Los resultados coincidentes conducen al mis-
mo diagnóstico, mientras que los no coincidentes pueden
llevar a diagnósticos equivocados. Las coincidencias de
los resultados de colesterol, glucosa y triglicéridos son
del 85,2%, 91,8% y 86,9%, respectivamente. Valores si-
milares fueron obtenidos por (9) que reportaron concor-
dancias entre 85 y 89% para colesterol y triglicéridos.
COLESTEROL
GLUCOSA
TRIGLICÉRIDOS
1
170 b
85,3 a
102 a
LABORATORIO
L2 L3 L4
L2 L3 L4 L2 L3 L4
L1
0,772**
0,896**
0,850**
0,734**
0,740**
0,871**
0,932**
0,901**
0,903**
L2
L3
0,829**
0,787**
0,719**
0,785**
0,928**
0,921**
4
174 b
93,7 c
107 a
0,921**
0,798**
0,893**
a
Los valores seguidos por la misma letra no presentan dife-
rencia significativa.
***: diferencia significativa a P < 0.001; *: diferencia signi-
ficativa a P < 0.05; NS: no significativa.
7
Figura 1. Matriz de correlación de laboratorios para glucosa
Tabla 3. Correlaciones entre laboratorios.
F *** *** NS
Tabla 2. Comparación por laboratorio.
a
2
142
a
88,2
b
98
a
3
189
c
86,6
ab
111
a
Labora- Colesterol Glucosa Triglicéridos
torio
[mg dL
-1
] [mg dL
-1
] [mg dL
-1
]
Tabla 1. Valores de colesterol, glucosa y triglicéridos.
Género
Labora-
torio
Colesterol
Glucosa
Triglicéridos
[mg dL
-1
]
d.e.r.
[mg dL
-1
]
d.e.r.
[mg dL
-1
]
d.e.r.
Masculino
1
175 ± 26
0,147
91,2 ± 7,3
0,080
123 ± 86
0,697
2
149 ± 22
0,148
91,5 ± 7,5
0,082
127 ± 85
0,670
3
189 ± 25
0,134
91,1 ± 8,0
0,088
140 ± 109
0,777
4
176 ± 23
0,132
98,6 ± 8,8
0,089
138 ± 106
0,767
Total
172 ± 28
0,161
93,1 ± 8,4
0,090
132 ± 95
0,718
Femenino
1
168 ± 26
0,154
83,4 ± 4,6
0,055
95 ± 39
0,413
2
140 ± 24
0,171
87,2 ± 5,6
0,064
88 ± 34
0,387
3
189 ± 31
0,166
85,2 ± 7,1
0,083
101 ± 50
0,498
4
173 ± 29
0,167
92,0 ± 5,5
0,060
96 ± 40
0,413
Total
168 ± 33
0,196
86,9 ± 6,6
0,075
95 ± 41
0,433
TOTAL
1
170 ± 26
0,152
85,3 ± 6,3
0,074
102 ± 55
0,538
2
142 ± 24
0,166
88,2 ± 6,3
0,072
98 ± 53
0,544
3
189 ± 30
0,158
86,6 ± 7,7
0,089
111 ± 70
0,635
4
174 ± 27
0,158
93,7 ± 7,0
0,075
107 ± 64
0,602
Total
169 ± 32
0,187
88,5 ± 7,5
0,085
104 ± 61
0,584
Correlación
a
F
LI
LS
LI
LS
Colesterol
Glucosa
Triclicéridos
0,840
0,768
0,972
21,946***
14,216***
35,321***
C1-C2
28,02
16,81
23,71
32,32
-5,61
61,64
a. El estimador es el mismo, esté presente o no el efec-
to de interacción.
0
13
86,7%
11
73,3%
11
73,3%
Masculino
4
0
0,0%
0
0,0%
4
26,7%
0
39
84,8%
45
97,8%
35
76,1%
Femenino
4
0
0,0%
0
0,0%
3
6,5%
0
52
85,2%
56
91,8%
46
75,4%
Total
T3-T4
4,31
31,69
-3,80
12,43
-59,06
67,68
4
0
0,0%
0
0,0%
7
11,5%
N: Número de laboratorios con resultados anómalos
para un mismo paciente.
a
Valor referencial hasta 120 mg dL
-1
.
b
Valor referencial hasta 105 mg dL
-1
.
c
Valor referencial hasta 160 mg dL
-1
para hombres y
hasta 135 mg dL
-1
para mujeres.
8
Figura 2. Gráfico de Bland-Altman.
Figura 3. Concordancias de resultados de los análisis
clínicos
Tabla 6. Laboratorios con resultados anómalos coin-
cidentes.
Tabla 4. Límites de confianza y de concordancia. LI: límite inferior, LS: límite
superior
1
6
9,8%
4
6,6%
4
6,6%
2
3
4,9%
0
0,0%
2
3,3%
3
0
0,0%
1
1,6%
2
3,3%
1
4
8,7%
1
2,2%
4
8,7%
2
3
6,5%
0
0,0%
2
4,3%
3
0
0,0%
0
0,0%
2
4,3%
1
2
13,3%
3
20,0%
0
0,0%
2
0
0,0%
0
0,0%
0
0,0%
3
0
0,0%
1
6,7%
0
0,0%
Género N Colesterol
a
Glucosa
b
Triglicéridos
c
Tabla 5. Coeficiente de correlación intraclase.
C1-C3
-19,16
13,29
-22,57
-15,76
-45,75
7,42
C1-C4
-3,93
14,68
-7,69
-0,17
-33,29
25,43
C2-C3
-47,18
16,73
-51,47
-42,89
-80,65
-13,71
C2-C4
-31,95
17,08
-36,33
-27,58
-66,12
2,22
C3-C4
15,23
11,60
12,26
18,20
-7,97
38,43
G1-G2
-2,94
4,61
-4,12
-1,76
-12,17
6,29
G1-G3
-1,32
5,20
-2,65
0,01
-11,71
9,08
G1-G4
-8,36
3,46
-9,24
-7,47
-15,27
-1,44
G2-G3
1,62
5,39
0,24
3,00
-9,17
12,41
G2-G4
-5,42
4,42
-6,55
-4,28
-14,26
3,43
G3-G4
-7,04
4,71
-8,25
-5,83
-16,46
2,38
T1-T2
4,33
19,98
-0,79
9,45
-35,64
44,29
T1-T3
-8,79
31,77
-16,92
-0,65
-72,33
54,76
T1-T4
-4,48
27,73
-11,58
2,63
-59,93
50,98
T2-T3
-13,11
28,88
-20,51
-5,72
-70,87
44,64
T2-T4
-8,80
25,70
-15,39
-2,22
-60,21
42,60
Media Desv. Est.
Confianza Concordancia
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Idrovo-Novillo, Gavilanes-Terán
Conclusiones
Para mejorar la concordancia de los resultados de dife-
rentes laboratorios sería necesario tener procesos de acre-
ditación de laboratorios.
Todos los pares de laboratorio están
correlacionados linealmente, pero esto
no significa que exista concordancia.
El 14,8% de los resultados respecto a
colesterol (13,3% en hombres y 15,2%
en mujeres), 8,2% respecto a glucosa
(26,7% en hombres y 2,2% en mujeres),
y 13,1% respecto a triglicéridos (0,0%
en hombres y 17,4% en mujeres) podrían
conducir a un diagnóstico médico equi-
vocado debido a la falta de coincidencia
entre los resultados de los diferentes la-
boratorios en los cuales se realizan los
análisis clínicos.
En el futuro se podrían ampliar los estudios comparativos
a otros parámetros clínicos, considerando laboratorios a
nivel nacional y en diferentes grupos etario.
Agradecimientos
Un sincero agradecimiento a los estudiantes de Bio-
química y Farmacia de la ESPOCH que contribuyeron
voluntariamente para la recolección de las muestras. Al
laboratorio clínico de la ESPOCH donde se tomaron y
dividieron las muestras.
R
eferencias
1. Instituto Nacional de Estadísticas y Censos. Encuesta Nacional de Salud y Nutrición: ENSANUT
2011-2013. 2012.
2. Souki-Rincón A, Cano-Ponce C, García-Camacho D, Mengual E, González C, Torres D, et al.
Variaciones por Edad y Sexo en el HOMAIR, en los niveles de Insulina y Glucosa séricas en niños
y adolescentes de Maracaibo-Estado Zulia. Archivos Venezolanos de Farmacología y Terapéutica.
2007;26:135-141.
3.
Freire W.B. RM, Belmont P., Mendieta MJ., Silva MK., Romero N., Sáenz K., Piñeiros P.,
Gómez LF., Monge R. RESUMEN EJECUTIVO. TOMO I. Encuesta Nacional de Salud y Nutrición
del Ecuador. ENSANUT-ECU 2011-2013. Quito: Ministerio de Salud Pública/Instituto Nacional de
Estadística y Censos. 2013; p. 23-27.
4. Delatour V, Lalere B, Saint-Albin K, Peignaux M, Hattchouel J-M, Dumont G, et al. Continuous
mprovement of medical test reliability using reference methods and matrix-corrected target values
n proficiency testing schemes: Application to glucose assay. Clinica Chimica Acta. 2012;413(23–
24):1872-1880.
5.
Forsman RW. Why is the laboratory an afterthought for managed care organizations? Clinical
Chemistry. 1996;42(5):813-819.
6.
Institute of Medicine. To Err Is Human: Building a Safer Health System. Kohn LT, Corrigan
JM, Donaldson MS, editors. Washington, DC: The National Academies Press; 2000.
7.
Nerenz RD, Pittman ME, Scott MG. Impact of Errors and Variability on Clinical Laboratory
Test Interpretation. In: Mitchell LMMN, editor. Pathobiology of Human Disease. San Diego:
Academic Press; 2014. p. 3222-3258.
8.
Zarski J-P, Sturm N, Guechot J, Paris A, Zafrani E-S, Asselah T, et al. Comparison of nine
blood tests and transient elastography for liver fibrosis in chronic hepatitis C: The ANRS HCEP-23
study. Journal of Hepatology. 2012;56(1):55-62.
9. Gialamas A, Laurence CO, Yelland LN, Tideman P, Worley P, Shephard MD, et al. Assessing
agreement between point of care and laboratory results for lipid testing from a clinical perspective.
Clinical Biochemistry. 2010;43(4–5):515-523.
10. Rahmé M, Lavigne M, Barry J, Cirtiu CM, Bélanger P, Vendittoli P-A. Whole blood metal
ion measurement reproducibility between different laboratories. The Journal of Arthroplasty.
2014;29(11):2214-2222.
9
i

10
11. Kramer CK, Vuksan V, Choi H, Zinman B, Retnakaran R. Emerging parameters of the
insulin and glucose response on the oral glucose tolerance test: Reproducibility and implications
for glucose homeostasis in individuals with and without diabetes. Diabetes Research and Clinical
Practice. 2014;105(1):88-95.
12. Pita Fernández S, Pértega Díaz S, Rodríguez Maseda E. La
fiabilidad
de las mediciones clínicas:
el análisis de concordancia para variables numéricas. Cad Aten Primaria. 2003;10(4):290-296.
13. Altman DG, Bland JM. Measurement in medicine: the analysis of method comparison studies.
The statistician.1983; 32: 307-317.
14. Bland JM, Altman D. Statistical methods for assessing agreement between two methods of
clinical measurement. The lancet. 1986;327(8476):307-317.
15. Molinero L. Errores de medida en variables numéricas: Correlación y Concordancia. SEH:
Asociación de la Sociedad Española de Hipertensión. 2001.
16. Prieto L, Lamarca R, Casado A. La evaluación de la fiabilidad en las observaciones clínicas: el
coeficiente de correlación intraclase. Medicina Clínica. 1998;110(4):142-147.
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105