
PREVALENCIA
Y DISTRIBUCIÓN DE LA INFECCIÓN
POR
VIRUS
PAPILOMA
HUMANO (HPV) EN ANORMALIDADES
EN
CÉLULAS EPITELIALES DEL CUELLO
UTERINO
Morelva Toro de Méndez
1
, Mercedes López de Sánchez
1
.
Grupo de investigaciones Citológicas. Cátedra de Citología
1
. Facultad de Farmacia y
Bioanálisis. Universidad de Los Andes. Mérida. Venezuela.
Contacto: tmorelva@ula.ve
R
esumen
A
bstract
40
The prevalence and distribution of HPV infection in patients consulting screening for cervical cancer
was evaluated. All patients had a smear and HPV test (PCR-RFLP). 3,883 cytological specimens
were processed: 3,651 (94.0%) smears were normal (NILM) and 201 (5.3%) had abnormalities
(AEC): 90 atypical squamous cells (2,32%), 77 squamous intraepithelial lesions (1.97%), 5 invasive
carcinomas (0.3%) and 29 smears with atypical glandular cells (0.75%). The overall prevalence of
HPV was 32.0%. 60.5% were HPV positive AEC. The HR-HPV was more frequently detected in
cancer (60.0%), HSIL (59.3%), LSIL (37.7%). HPVX sequences were detected in 30.0% of ASC-H,
22.9% of ASC-US and LSIL and 20.0% of cancer. The most common HPV were: HPV6 (17.3%),
HPV31 (16.0%), HPV16 (13.3%) and HPV18 and 56 genotypes in the same proportion (6.7%). The
HPV16 was more frequent in the ASC-US (23.8%), HPV6 (19.0%) and HPV51 (9.5%). In LSIL,
HPV31 (19.2%), HPV6 (19.2%) and HPV56 (15.4%); the HPV31 (33.3%) in HSIL, The HPV16
was detected in 100% of cervical cancers. It is necessary to establish epidemiology characteristics
of HPV infection in the rest of the Venezuelan population before implementing strategies to prevent
cervical cancer.
Keywords: solar sterilizer by dry process, design, construction, evaluation
Se evaluó la prevalencia y distribución de la infección por HPV en pacientes para pesquisa de cáncer
de cuello uterino. Todas las pacientes tenían una citología y una prueba para HPV. Se procesaron 3.883
muestras citológicas: 3.651 (94,0%) eran normales (NILM) y 201(5,3%) con anormalidades (AEC):
90 células escamosas atípicas (2,32%), 77 lesiones intraepiteliales escamosas (1,97%), 5 carcinomas
invasores (0,3%) y 29 citologías con células glandulares atípicas (0,75%). La prevalencia general
de HPV fue de 32,0%. El 60,5% de AEC fueron HPV positivas. Los HPV-AR fueron detectados
en cáncer (60,0%), HSIL (59,3%), LSIL (37,7%). Secuencias HPVX fueron detectadas en 30,0%
de ASC-H, 22,9% de ASC-US y 20,0% de LSIL y cáncer. Los HPV más frecuentes fueron: HPV6
(17,3%), HPV31 (16,0%), HPV16 (13,3%) y HPV18 y 56 en la misma proporción (6,7%). El HPV16
fue más frecuente en las ASC-US (23,8%), HPV6 (19,0%) y HPV51 (9,5%). En las LSIL: HPV31
(19,2%), HPV6 (19,2%) y HPV56 (15,4%); en las HSIL: HPV31 (33,3%). El HPV16 se detectó en
el 100% de los cánceres cervicales. Es necesario establecer las características epidemiológicas de
la infección por HPV en el resto de la población venezolana, antes de implementar estrategias de
prevención del cáncer cervical.
Palabras claves: citología de cuello uterino, anormalidades celulares, hpv, prevalencia
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Toro de Méndez, López de Sánchez
Significado de las siglas utilizadas en
este artículo:
de alto riesgo oncogénico de Virus Papiloma Humano
(HPV) es considerada actualmente el principal factor de
riesgo necesario para el desarrollo de cáncer invasor de
cuello uterino y sus lesiones precursoras (4,5,6,7). Se
han identificado alrededor de 170 genotipos específicos
de HPV y clasificado, de acuerdo a su asociación con
cáncer y lesiones precursoras, en: de bajo riesgo (BR) y
de alto riesgo (AR). Entre los HPV-AR se incluyen los
genotipos HPV16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56,
58, 59, 66, 68, 70, 73 y 82, mientras que entre los HPV-
BR están incluidos los genotipos HPV 6, 11, 42, 43, 44
y 55, entre otros (8, 9,10). La prevalencia y distribución
de la infección por HPV varía de manera considerable
geográficamente, dependiendo de la población estudiada,
en particular de sus características inmunológicas,
la existencia o no de lesiones en cuello uterino y
fundamentalmente del método molecular que se utilice
para detectar y genotipificar el ADN viral (11,12,13,14).
NILM negativa para lesión intraepitelial
escamosa o malignidad.
AEC
anormalidades
en
células
epiteliales.
AGC células glandulares atípicas.
ASC-H células con atipias que no
excluyen
una
lesión intraepitelial
escamosa de alto grado.
ASC-US
células
con atipias
de
significado indeterminado.
CIN neoplasia intraepitelial cervical.
SIL lesión intraepitelial escamosa.
LSIL lesión intraepitelial escamosa de
bajo grado.
HSIL lesión intraepitelial escamosa de
alto grado.
HPV virus papiloma humano.
Así tenemos que la infección por HPV puede presentarse
en el 10,7% de las pacientes con citología normal (4),
cerca del 90% de los cánceres de cuello uterino (6),
mientras que en pacientes con citología compatible con
atipias en células escamosas de significado indeterminado
(ASC-US) y lesión intraepitelial escamosa de bajo grado
(LSIL) puede alcanzar el 82,9% (15) y en las pacientes
con lesión intraepitelial escamosa de alto grado (HSIL)
se presenta en más del 50% (4,12,16).
HPV-BR virus papiloma
bajo riesgo oncogénico.
HPV-AR virus papiloma
alto riesgo oncogénico.
humano
de
humano
de
HPVX virus papiloma humano
identificado.
no
PCR
reacción
en
cadena de
la
polimerasa.
RFLP Restriction Fragment Length
Polymorphism
/ Polimorfismos de
En Venezuela, el cáncer de cuello uterino continúa siendo
un problema de salud pública relevante, cuyo diagnóstico
inicial se basa en el estudio morfológico de las células
que se descaman de este órgano. A pesar de ello, en este
país no se han llevado a cabo estudios de población a
gran escala, que incluyan casos-controles, para conocer
la prevalencia real y el patrón de distribución de los
genotipos de HPV más frecuentes.
longitud de fragmentos de restricción.
Intoducción
El cáncer de cuello uterino constituye la
segunda causa de mortalidad femenina a
nivel mundial (1). Se ha informado que
en Venezuela, para el año 2008, fueron
diagnosticados 3.785 nuevos casos de
cáncer cervical y 1.571 muertes por
esta neoplasia (2). El cáncer de cuello
uterino se encuentra precedido por
un espectro de lesiones precursoras
Las
escasas investigaciones que se han realizado
incluyen poblaciones muy particulares, como pacientes
con citologías anormales (17,18,19,20) o con lesiones en
cuello uterino confirmadas por estudio histopatológico
(21,22). Según estas investigaciones, la prevalencia
general de infección por HPV oscila entre el 53,4%
y 98,9% y la prevalencia del HPV-AR es de 82,9%
a 98,9% (17, 21,22). El HPV16 es el genotipo viral
oncogénico más frecuentemente detectado, alcanzando
hasta el 63,3% en las lesiones consistentes con neoplasia
intraepitelial cervical grado 3/CIN3 y 68,4% en cáncer
invasor (22).
denominadas
histopatológicamente
Neoplasia Intraepitelial Cervical (CIN)
y en citología de cuello uterino, Lesión
Intraepitelial Escamosa (SIL), según el
Sistema Bethesda 2001 (3).
La infección persistente por genotipos
41

Es imperioso entonces contribuir en el establecimiento
de las características epidemiológicas de la población
venezolana que permita, de manera efectiva, la
planificación eficaz de estrategias de prevención del
cáncer de cuello uterino, basado en una metodología de
detección y genotipificación de HPV complementaria
al estudio citológico.
se retiró el hisopo o cepillo cervical.
Después de centrifugar a alta velocidad,
al paquete celular se le añadió 400μL de
tampón de extracción (Tris-HCl 0,2 M
pH 8; EDTA 0,025 M; NaCl 0,1 M; y
SDS 0,2 %), proteinasa K 0,2 mg (20
mg/mL) y 20μL de SDS 10 %. Se incubó
toda la noche a 55º C. Posteriormente
se añadió 100μL de Chelex-100 al 5
% y se calentó por 10 minutos a 95º C.
A continuación se añadió un volumen
El objetivo de este estudio fue evaluar la prevalencia
de infección por HPV y distribución de los genotipos
virales que frecuentemente infectaron a las pacientes
merideñas que acudieron a la consulta de pesquisa de
cáncer de cuello uterino.
de
fenol-cloroformo-isoamilalcohol
(24:23:1) y se agitó en vórtex, a la fase
acuosa separada se le añadieron dos
volúmenes de etanol absoluto y 0,2
volúmenes de acetato de amonio 10 M.
Materiales y Métodos
Material. Durante el período comprendido entre
marzo de 2006 y febrero de 2012, se analizaron e
informaron las citologías de cuello uterino, según los
criterios establecidos por el Sistema Bethesda 2001
(3), provenientes de las pacientes que acudieron a la
consulta de rutina de pesquisa de cáncer de cuello
uterino y atendidas por el programa Misión Barrio
Adentro, pertenecientes a comunidades rurales y del área
metropolitana del Estado Mérida, Venezuela. A toda la
población estudiada se le realizó simultáneamente, un
hisopado cervical para la detección y genotipificación
molecular de HPV, mediante la metodología PCR-
Se dejó precipitar el ADN por 48 horas
a -20º C, y se procedió a centrifugar
para bajar el precipitado. El ADN fue
resuspendido en 50μL de tampón TE 10
mM pH 8.
Las muestras de ADN fueron sometidas a
una reacción en cadena de la polimerasa
(siglas en inglés, PCR) que amplifica un
fragmento del gen de la beta-globina, para
determinar la calidad del ADN. Para la
PCR de detección de HPV, se utilizaron
3 a 5μL de la preparación de ADN. La
mezcla de reacción consistió de tampón
de PCR 1X, 5,5 mM de MgCl, 200uM de
dNTP„s,
50 picomoles de cada uno de los
iniciadores MY09/MY11 y 2,5 U de Taq
Polimerasa (Invitrogen). La reacción se
sometió a amplificación utilizando un
termociclador PTC-100 MJ Researchs
con el siguiente programa: 1 min a 94º
C, 30 s a 55º C y 1 min a 72º C.
RFLP
(Polymerase
Chain
Reaction-Restriction
Fragment Length Polymorphism).
Método. Las muestras celulares de cuello uterino
para pesquisa de cáncer fueron tomadas de forma
convencional, utilizando espátula de Ayre y cepillo
endocervical,
luego
fueron fijadas
con
cytofix
y posteriormente coloreadas con la técnica de
Papanicolaou, en el Laboratorio Docente, Asistencial
y de Investigación “Licda. Celina Sánchez Rincón” de
la Cátedra de Citología de la Facultad de Farmacia y
Bioanálisis, Universidad de Los Andes.
Los amplificados fueron sometidos a
análisis de restricción con las enzimas
endonucleasas DdeI, RsaI, PstI, y
HindfI. La mezcla consistió de: 10μL
del amplificado, 2 unidades de enzima,
tampón de reacción 1X y agua estéril
para un volumen final de 20μL. La
mezcla se incubó por 1 hora a 37º C y
se inactivó la enzima por calentamiento
a 65º C por un minuto. Para visualizar
Para la detección y genotipificación del HPV se tomaron
muestras de cuello uterino con hisopo, las cuales se
procesaron y analizaron en el Laboratorio de Biología
y Medicina Experimental (LABIOMEX) de la Facultad
de Medicina, Universidad de Los Andes, para extraer
el ADN mediante el método clásico
con fenol-cloroformo con algunas
Brevemente, a los hisopados se les
de precipitación
modificaciones.
añadió solución
salina al 0,8 % y se incubó por 2 horas a 37º C y luego
42
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105
Toro de Méndez, López de Sánchez
el patrón de bandas digeridas, 5μL del
digerido se sometió a electroforesis en
gel de agarosa 2,5 % en tampón TBE
1X. El patrón fue comparado contra
patrones de digestión conocidos para
su identificación (23). Las secuencias
virales no identificadas se señalaron
como HPVX.
La detección de dos o más secuencias de
ADN HPV detectadas simultáneamente
en una misma muestra se consideró una
infección múltiple por HPV. Los datos
fueron analizados con el programa
estadístico SPSS versión 17,0 y los
resultados se presentan en cuadros y
figuras.
Resultados
Se procesaron 3.883 muestras citoló-
gicas de cuello uterino. La edad de las
pacientes estudiadas estaba comprendi-
da en el rango de 13 a 89 años, con una
media de 34,8 años ± 12,2 años.
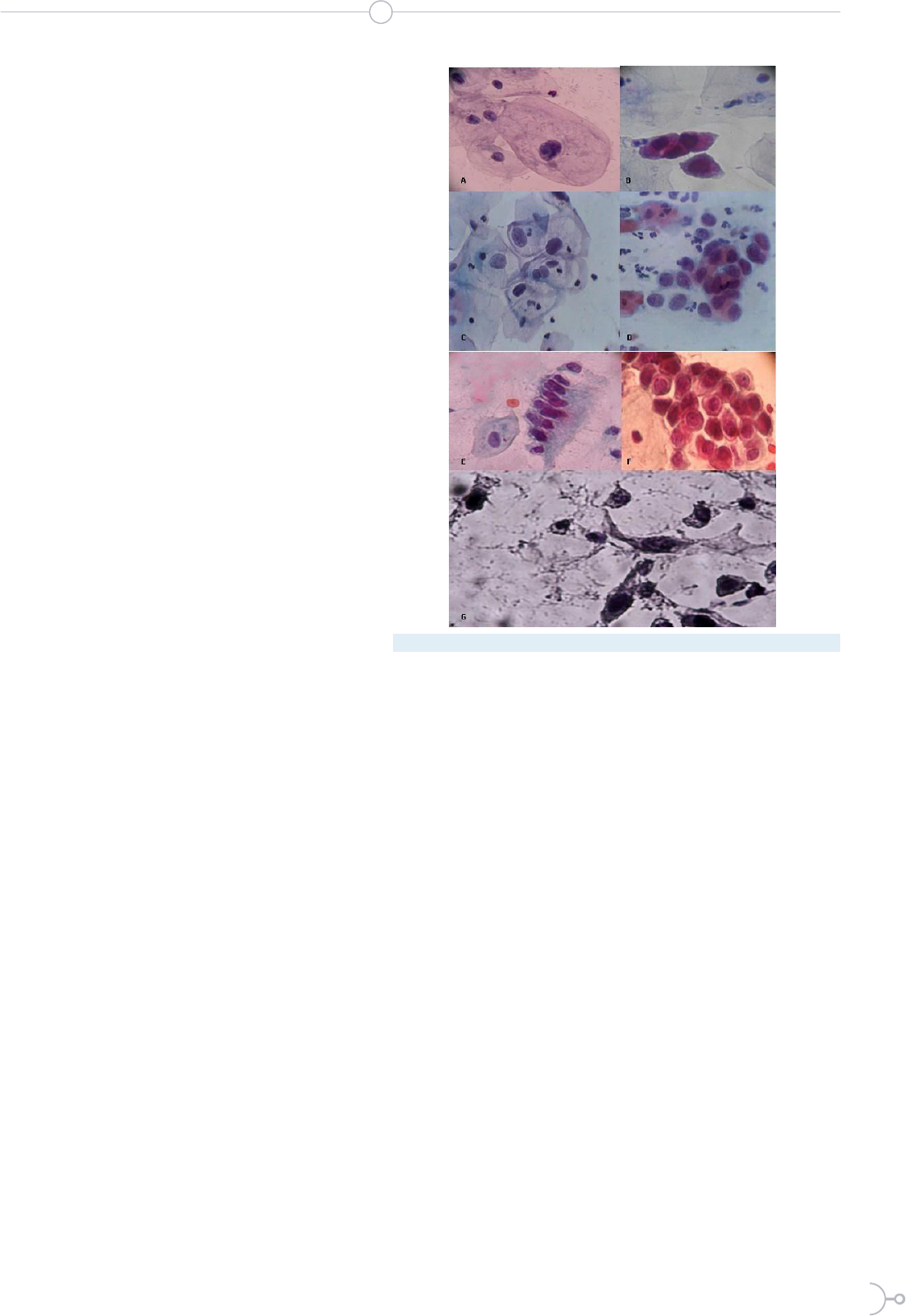
Imágenes citológicas de anormalidades en células epiteliales de las muestras
de cuello uterino de este estudio. Coloración de Papanicoalou. A. Célula
escamosa de tipo intermedio atípica, con aumento del tamaño nuclear
y megalocitosis (20X). B. Células metaplásicas inmaduras atípicas, con
hipercromasia nuclear y megalocariosis discreta (40X). C. Lesión Intraepitelial
Escamosa de bajo grado (LSIL/HPV). Coilocitos asociados a infección por
HPV (20X). D. Lesión Intraepitelial Escamosa de alto grado (HSIL). Células
metaplásicas inmaduras discarióticas (40X). E. Células endocervicales
en empalizada atípicas, con anisocariosis y pleomorfismo nuclear (20X).
F. Células endocervicales en panal atípicas, destacando la anisocariosis
discreta y halos perinucleares rígidos, probablemente asociados a infección
por HPV (40X). G. Células pleomórficas con características de malignidad,
sobre fondo diatésico, compatible con carcinoma invasor de cuello uterino
(40X).
Se obtuvieron 3.651 (94,0%) citolo-
gías negativas para lesión intraepite-
lial o malignidad (NILM) y 201(5,3%)
casos tenían anormalidades en células
epiteliales (AEC), distribuidos así: 90
células escamosas atípicas (2,32%): 80
ASC-US (2,06%) y 10 ASC-H (0,25%),
77 lesiones intraepiteliales escamosas
(1,97%): 50 LSIL (1,28%) y 27 HSIL
(0,69%), 5 cánceres invasores (0,3%) y
29 casos con células glandulares atípi-
cas (0,75%). 31 muestras celulares fue-
ron inadecuadas para estudio citológico
(1,0%).
La prueba molecular para detección y genotipificación
de HPV se realizó a las 3.883 muestras cervicales. De
estas, fueron excluidas 113 porque no tenían resultado
de la prueba molecular y 137 porque fueron inadecuadas
para ese estudio.
Imágenes citológicas de anormalida-
des celulares se muestran en la Figura 1.
La muestra final fue de 3.633 casos con citología y
resultado de la prueba de HPV. Del total de muestras
analizadas (3.633) resultaron positivas para la prueba
de HPV 1.160 (32,0%). En el 10,4% se detectó HPV-
AR. Una secuencia viral no identificada (HPVX) estaba
presente en el 13,8% de las muestras. De los 201 casos
con anormalidades en células epiteliales, 185 tenían
disponible los resultados de la prueba de HPV, de los
cuales 112 fueron positivos (60,5%): 37 ASC-US, 4
43
Figura 1
ASC-H, 36 LSIL, 23 HSIL, 4 cánceres y 8 AGC. Los
HPV-AR fueron más frecuentemente detectados en
cáncer (60,0%), HSIL (59,3%), LSIL (37,7%). En los
casos de atipias también fueron detectados: ASC-US
(17,1%) y AGC (10,7%). Secuencias de HPVX fueron
detectadas en 30,0% de ASC-H, 22,9% de ASC-US,
en el 20,0% de LSIL y cáncer; en el 18,6% HSIL y
en el 3,7% de las AGC. El 20,0% de las LSIL tenían
positividad para un tipo de HPV-BR seguidas del 14,3%
de las AGC y ASC-US (12,9%). La infección múltiple
por HPV fue poco frecuente: un caso de ASC-H y uno
de LSIL. Estos resultados se presentan en el Tabla I. La
distribución porcentual de los genotipos específicos de
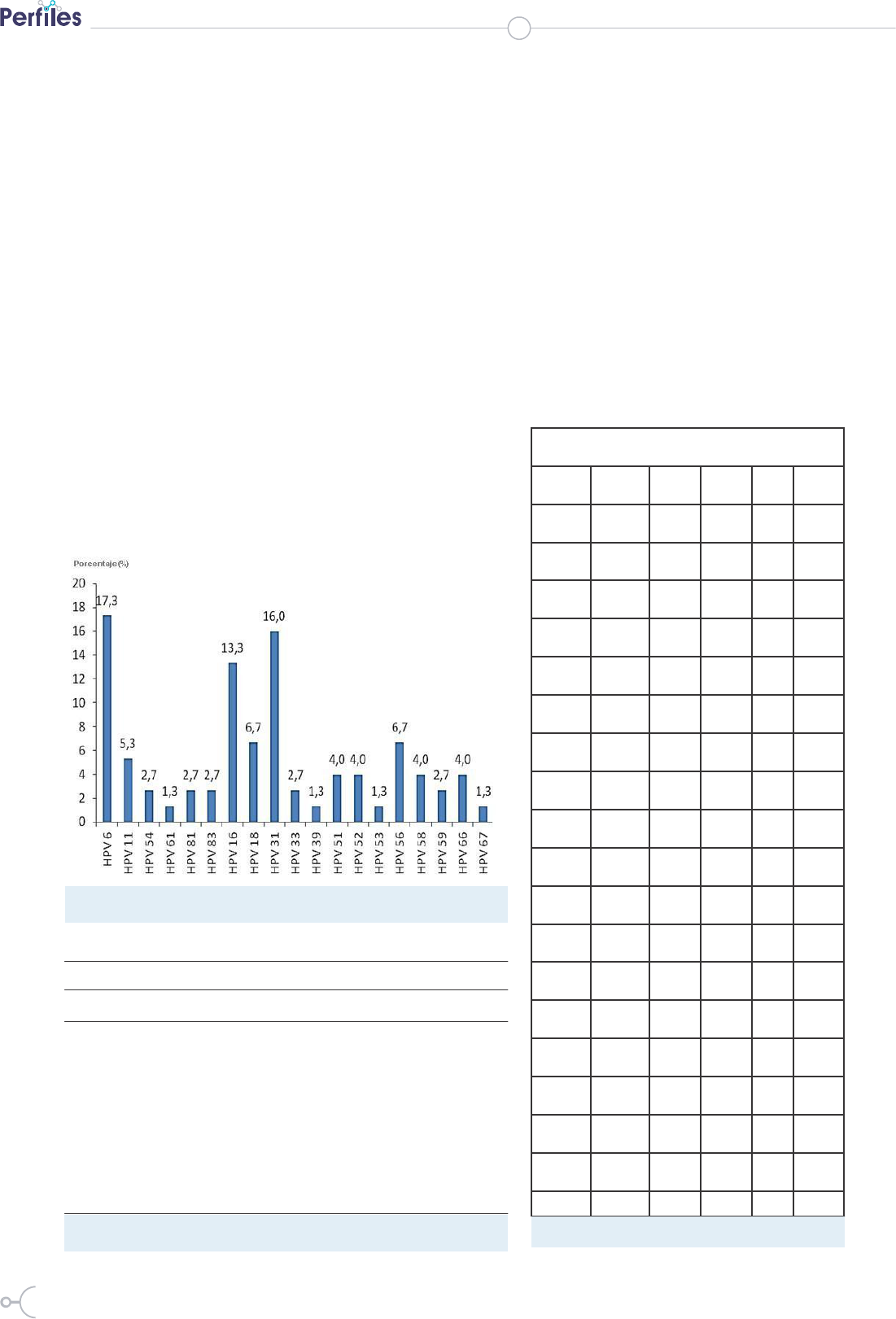
HPV hallados en este estudio se presenta en la Figura 2.
En orden decreciente, los HPV más frecuentes fueron:
HPV6 (17,3%), HPV31 (16,0%), HPV16 (13,3%) y los
HPV18 y HPV56, ambos en la misma proporción (6,7%).
En la Tabla II se aprecia la distribución de los genotipos
específicos de HPV, observándose que ésta varía entre
las diferentes anormalidades en células
epiteliales. En los casos categorizados
como ASC-US los tres genotipos virales
de mayor prevalencia fueron el HPV16
(23,8%),
HPV6
(19,0%), HPV51
(9,5%), en las LSIL: HPV31 (19,2%),
HPV6 (19,2%), HPV56 (15,4%) y en las
HSIL: HPV31 (33,3%) y en la misma
proporción: HPV16, HPV18 y HPV58
(11,1%). El HPV16 se detectó en todos
los casos de cáncer invasor (100%). Los
genotipos más comunes en las citologías
con AGC fueron
HPV 52 (28,6%).
el
HPV 6 (42,9%) y
casos con anormalidades en células epiteliales.
Anormalidades en células epiteliales.
ASC-US
(%)
ASC-H
(%)
Prueba HPV
LSIL (%)
HSIL (%)
Ca (%)
AGC (%)
Negativa
33 (47,1)
6 (60,0)
9 (20,0)
4 (14,8)
1 (20,0)
20 (71,4)
Positiva
37 (52,9)
4 (40,0)
36 (80,0)
23 (85,2)
4 (80,0)
8 (28,6)
HPV BR
9 (12,9)
0
9 (20,0)
2 (7,4)
0
4 (14,3)
HPV AR
12 (17,1)
0
17 (37,7)
16 (59,3)
3 (60,0)
3 (10,7)
HPV X
16 (22,9)
3 (30,0)
9 (20,0)
5 (18,6)
1 (20,0)
1 (3,7)
Infección múltiple 0
1 (10,0)
1 (2,3)
0
0
0
44
TABLA I. Infección por HPV en citologías con anormalidades en células
epiteliales.
Figura 2. Distribución porcentual de los genotipos específicos de HPV en los
ANORMALIDADES EN CÉLULAS EPITELIALES
Genotipos
HPV
ASC-US
(%)
LSIL(%)
HSIL(%)
Ca(%)
AGC(%)
HPV 6
4(19,0)
5(19,2)
1(5,6)
0
3(42,9)
HPV 11
1(4,8)
2(7,7)
1(5,6)
0
HPV 54
1(4,8)
1(3,8)
0
0
HPV 61
1(4,8)
0
0
0
HPV 81
1(4,8)
1(3,8)
0
0
HPV 83
1(4,8)
0
0
0
1(14,3)
HPV 16
5(23,8)
0
2(11,1)
3(100)
HPV 18
2(9,5)
1(3,8)
2(11,1)
0
HPV 31
1(4,8)
5(19,2)
6(33,3)
0
HPV 33
0
1(3,8)
1(5,6)
0
HPV 39
1(4,8)
0
0
0
HPV 51
2(9,5)
0
1(5,6)
0
HPV 52
0
1(3,8)
0
0
2(28,6)
HPV 53
0
1(3,8)
0
0
HPV 56
0
4(15,4)
1(5,6)
0
HPV 58
0
1(3,8)
2(11,1)
0
HPV 59
1(4,8)
0
1(5,6)
0
HPV 66
0
3(11,5)
0
0
HPV 67
0
0
0
0
1(14,3)
TABLA II: Prevalencia de los genotipos específicos de
HPV en las anormalidades en células epiteliales.
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Toro de Méndez, López de Sánchez
Díscusión
estudio fue de 32,0%, la cual es semejante al 34,2%
encontrada en el estudio de 60.775 pacientes realizado
en Korea por Lee y col en 2012 (27), quienes utilizaron
un procedimiento de tipificación viral similar al de este
estudio y quienes además hallaron 16% de citologías con
anormalidades en células epiteliales.
La genotipificación de HPV se ha ido
incorporando a la pesquisa de rutina de
cáncer de cuello uterino y actualmente
este resultado es considerado en los
diferentes algoritmos de manejo clínico
durante las consultas ginecológicas (24).
Así mismo, el conocimiento del patrón
de infección por HPV es de interés para
el diseño de estrategias de prevención
como vacunas específicas, de mayor
eficacia para las diferentes poblaciones,
También Argiry y col 2013 (28) obtuvieron una
prevalencia de HPV (33,1%) semejante a la del presente
estudio; su investigación incluyó 3.170 pacientes
griegas con citologías normales y anormales, aunque la
metodología utilizada fue ADN HPV-Chip.
de acuerdo con sus
epidemiológicas (25).
características
En Venezuela, la presencia de HPV en pacientes con
citologías o biopsias anormales varía entre el 53,4% y
98,9% (17,19,21,22). Las variaciones en la prevalencia
podrían deberse a la inconstancia en el número y tipo
de lesiones incluidas en cada estudio, al número y tipo
de interpretaciones citológicas o histopatológicas y a la
metodología utilizada en estos, según explican Lee y col
2012 (27), Dunsun y col 2013 (29) y Zhou y col 2014
(30). En este estudio, se observó que el 60,5% de las
citologías categorizadas como AEC eran positivas para
la prueba de HPV, similar a lo informado por de Jonge y
col 2013 (31) y difiriendo ligeramente de otros estudios
desarrollados en Venezuela (17,21,22), coincidiendo
con otras investigaciones en que a medida que aumentó
la severidad de la lesión, se incrementó también la
prevalencia de HPV (11, 28,32).
La determinación de la prevalencia
de infección por HPV es útil en la
clasificación de las pacientes que
presentan resultados citológicos con
AEC,
especialmente en el
triage
de ASC-US/LSIL y
que requieren
tratamiento
inmediato y vigilancia
periódica, para evaluar su
verdadero
riesgo de desarrollar una lesión cervical
clínicamente significativa. El riesgo de
progresión a cáncer de cuello uterino
varía dependiendo del genotipo de HPV
presente. Los HPV-AR como el HPV16
y HPV18, entre otros de alto riesgo
oncogénico, son los más asociados con
un riesgo elevado de desarrollar lesiones
de alto grado, como CIN2/3-carcinoma
in situ (4,6,8,16,25,26). La prevalencia
y distribución de los genotipos de HPV
en las distintos investigaciones varía
considerablemente en las diferentes
regiones del mundo y nacionales,
La distribución de los genotipos específicos de HPV
también muestra variación geográficamente (33,34).
Esta variación posiblemente se debe al tipo de lesiones
cervicales estudiadas, a la heterogeneidad en las
características epidemiológicas de las poblaciones y a la
de los protocolos de detección y genotipificación de HPV
utilizados en los diferentes estudios (27). El HPV 16 es
el genotipo de HPV oncogénico más frecuentemente
detectado en pacientes con cáncer y lesiones premalignas
de cuello uterino, tanto por citología como por biopsia
(7,14, 21,22,35), así como en pacientes con citologías
normales (33).
señalándose
básicamente
que
estas
variables dependen de aspectos que
se continúan repitiendo, cuando se
consulta la literatura relacionada, como:
características epidemiológicas de la
población que se estudia incluyendo el
estado inmunológico y de los diferentes
métodos moleculares utilizados para la
detección y genotipificación del ADN
HPV.
En las pacientes con cáncer cervical del presente
estudio, el HPV16 fue el único genotipo viral detectado
(100%). Esto indica que aun cuando hay marcadas
diferencias en la prevalencia de HPV en las diferentes
categorías citológicas (ASC-US, ASC-H, LSIL, HSIL)
entre regiones y países, el HPV16 continúa siendo el
principalmente asociado al cáncer de cuello uterino (31).
La prevalencia general de HPV en este
45

Contrario a lo reflejado en la mayoría
de los estudios, tanto a nivel mundial
como en Venezuela, en este estudio,
el HPV31 fue detectado con mayor
frecuencia que el HPV16, sobre todo
en los casos de lesiones premalignas
(LSIL y HSIL). El HPV31 también fue
hallado en otros estudios que incluyeron
cáncer y CIN2/3 del cuello uterino
(4,13,16,21,22,25,31,36).
a 10% (38), quienes usaron el mismo método de
genotipificación que en este estudio. Se deben realizar
investigaciones futuras con técnicas moleculares
como la secuenciación, que permitan identificar estos
genotipos desconocidos de HPV a fin de establecer el
verdadero patrón de infección por HPV en esta región.
El 28,6% de las atipias en células glandulares (AGC)
de cuello uterino incluidas en este estudio fue positivos
para HPV.
El rango de infección por HPV en pacientes con AGC
oscila entre 25,0% y 38,0% (39,40,41). La presencia
de AGC es un hallazgo citológico infrecuente, pero
su importancia clínica radica en que un elevado
porcentaje de pacientes HPV positivas con este tipo de
resultado citológico está asociado a un mayor riesgo
de adenocarcinoma endocervical (40). Además, un
porcentaje significativo de pacientes con AGC podría
presentar una biopsia positiva para HSIL o cáncer
invasor, así como neoplasia extrauterina (42,43,44).
Por ello, en las recomendaciones para el manejo clínico
de las pacientes con AGC se incluye específicamente
la detección de HPV-AR, para identificar aquellas con
un riesgo elevado de padecer una lesión significativa
(24,45,46).
Según Halfon y col 2013 (16), el 52%
de las pacientes con HPV31 podría tener
mayor riesgo a desarrollar una lesión
intraepitelial cervical grado 2 o más
(CIN2+) en comparación con el 58% si
fuese HPV16 ó 28% si fuese HPV18.
La inclusión de genotipos de HPVAR
diferentes a los HPV16 y 18, como los
HPV31, 33, 45, 52, 56 y 58, en vacunas
de segunda generación, actualmente en
desarrollo (37), podrían prevenir casi el
90% de los cánceres invasores de cuello
uterino a nivel mundial. También los
genotipos HPV51, 52, 56 y 58 fueron
frecuentes en algunas de las categorías
citológicas de este estudio, coincidiendo
con otros estudios venezolanos (21,22).
El HPV52 ha sido detectado con
frecuencia en casos de cáncer y CIN2/3
en pacientes venezolanas (21,22).
En el estudio de Namugenyi y col 2013 (40),
quienes estudiaron 53 casos de AGC y 338 controles
encontraron que el 13,2% era positivo para HPV-BR y
el 20,8% para HPV-AR, mientras que en este estudio
correspondió a 14,3% (HPV6 y HPV83) y 10,7%,
(HPV16 y HPV52), respectivamente. En otro estudio
que incluyó aproximadamente 10.000 citologías en
base líquida, obtenidas de pacientes de un programa
de pesquisa de cáncer cervical en Bélgica, hallaron
positividad para HPV-AR en el 32,0% de las citologías
cervicales con AGC (36). Aunque el número de casos
con AGC de este estudio era bajo, se recomienda realizar
estudios en este tipo de pacientes para establecer sus
características y riesgos de desarrollar neoplasia. En
este estudio, el HPV6 fue el genotipo de HP-BR más
frecuente (17,3%). Los HPV de bajo riesgo oncogénico
son la causa más frecuente de una elevada proporción
de verrugas genitales, cuyas citologías cervicales
muestran compatibilidad con ASC-US/LSIL (14,47).
Por
ello, debe
investigarse
la
participación
de
estos otros
genotipos oncogénicos de HPV en la
carcinogénesis del cuello uterino de las
pacientes de este medio, para determinar
si es necesaria su inclusión o no en las
futuras vacunas polivalentes de segunda
generación (25,27,29). Así como si son
de interés local para el manejo clínico
conveniente de las pacientes y en el
diseño de metodologías de detección de
HPV.
En este estudio, de manera llamativa,
se obtuvo un 18,9% de secuencias
virales que no pudieron ser identificadas
(HPVX), porcentaje mayor al informado
por Aedo y col 2007, el cual fue igual
Los hallazgos de este estudio deben interpretarse con
mesura debido a las siguientes limitaciones: en primer
lugar, se estudió sólo una parte de la población, no
siendo representativa de toda la región merideña, por lo
46
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Toro de Méndez, López de Sánchez
que sería necesario ampliar la cobertura,
de manera que se pueda disponer de
datos más precisos, tanto a nivel regional
como nacional. En segundo lugar,
no se dispuso de suficientes datos de
seguimiento de la población estudiada
para complementar la información.
estudio permiten concluir que en esta región, la infección
por HPV oncogénico es elevada en pacientes con
anormalidades en células epiteliales del cuello uterino.
El HPV31 es un genotipo oncogénico bastante frecuente
en pacientes con citologías anormales, además de los
genotipos HPV16, 18 y 56, por lo que antes de implementar
cualquier estrategia de prevención del cáncer de cuello
uterino, como un programa de vacunación nacional, es
necesario establecer las características epidemiológicas
de la infección por HPV en la población venezolana,
utilizando protocolos moleculares estandarizados para
su detección y genotipificación, para caracterizar con
mayor exactitud a la población y determinar el impacto
de las vacunas existentes y de segunda generación, en la
población venezolana.
Y finalmente, la comparación
de
prevalencia
y
distribución
de los
genotipos de HPV en esta región
con
la global se vio afectada debido a
que la metodología utilizada en este
estudio fue diferente a la que se utiliza
frecuentemente en las investigaciones,
tanto nacionales como internacionales.
Además, hubo una alta proporción de
HPVX, no identificados, impidiendo
el establecimiento más exacto de la
prevalencia de genotipos específicos
de HPV. En base a estas limitaciones,
recomendamos ampliar la población
Agradecimientos
Las autoras manifiestan su agradecimiento al FONACIT
por el financiamiento parcial de este proyecto:
FONACIT N° 2005000180 y al personal Asistencial
y Técnico de la Cátedra de Citología de la Facultad de
Farmacia y Bioanálisis-ULA, y muy especialmente a los
profesores Militza Quintero Vega y Jhon Cruz Gómez
de LABIOMEX, Facultad de Medicina, Universidad
de Los Andes, quienes se encargaron de la detección
y genotipificación de HPV en las muestras cervicales
incluidas en este estudio.
estudiada,
específico
HPVX y
identificar el genotipo viral
en los casos positivos para
determinar la prevalencia
general de esta infección incluyendo
casos y controles. De ser posible, realizar
seguimiento a los casos con ACE por
biopsia, que permitan correlacionar
la oncogenicidad del genotipo viral
Conflicto de intereses
Los autores declaran
intereses.
detectado con
la presencia de lesiones
la
inexistencia
de
conflictos
de
en
cuello
uterino
clínicamente
significativas.
R
Los hallazgos de este
eferencias
47
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. 2008. Estimates of worldwide
burden of cancer in 2008: GLOBOCAN. Int J Cancer.127:2893-2917.
2. Capote Negrín L. 2013. Perfil epidemiológico y control del cáncer en Venezuela. Gac Med
Caracas.121:43-52.
3. Solomon D, Nayar R. 2004. The Bethesda System for reporting cervical cytology. Springer.
Definitions, Criteria, and Explanatory Notes. Springer. ISBN 978-0-387-40358-8.
4. Smith JS, Lindsay L, Hoots B, Keys J, Franceschi S, Winer R, et al. 2007. Human papillomavirus
type distribution in invasive cervical cancer and high-grade cervical lesions: a meta-analysis update.
Int J Cancer. 121:621-632.
5. de Sanjose S, Quint WG, Alemany L, Geraets DT, Klaustermeier JE, Lloveras B, et al. 2010.
Retrospective International Survey and HPV Time Trends Study Group. Human papillomavirus
genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study.
Lancet Oncol. 1048-1056.
6. Alemany L, Pérez C, Tous S, Llombart-Bosch A, Lloveras B, Lerma E, et al. 2011. Spanish
study group RIS HPV TT. Human papillomavirus genotype distribution in cervical cancer cases in

48
Spain. Implications for prevention. Gynecol Oncol. 124:512-517.
7. Alemany L, de Sanjosé S, Tous S, Quint W, Vallejos C, Shin HR, et al. 2014. RIS HPV TT
Study Group. Time trends of human papillomavirus types in invasive cervical cancer, from 1940 to
2007. Int J Cancer.135:88-95.
8. Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. 2003.
International Agency for Research on Cancer Multicenter Cervical Cancer Study Group.
Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl
J Med. 348:518-527.
9. de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. 2004. Classification of
papillomaviruses. Virology. 324:17-27.
10. de Villiers EM. Cross-roads in the classification of papillomaviruses. 2013. Virology. 445:2-
10.
11. Nobre RJ, Cruz E, Real O, de Almeida LP, Martins TC. 2010. Characterization of common
and rare human papillomaviruses in Portuguese women by the polymerase chain reaction, restriction
fragment length polymorphism and sequencing. J Med Virol. 82:1024-1032.
12. Tricco AC, Ng CH, Gilca V, Anonychuk A, Pham B, Berliner S. 2011.Canadian oncogenic
human papillomavirus cervical infection prevalence: systematic review and meta-analysis. BMC
Infect Dis. 11:235-246.
13. Martín P, Kilany L, García D, López-García AM, Martín-Azaña MJ, Abraira V, et al. 2011.
Human papillomavirus genotype distribution in Madrid and correlation with cytological data. BMC
Infect Dis. 11:316-320.
14. Bzhalava D, Guan P, Franceschi S, Dillner J, Clifford G. 2013. A systematic review of the
prevalence of mucosal and cutaneous human papillomavirus types. Virology. 445:224-231.
15. Human papillomavirus testing for triage of women with cytologic evidence of low-grade
squamous intraepithelial lesions: baseline data from a randomized trial. The Atypical Squamous
Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesions Triage Study
(ALTS) Group. J Natl Cancer Inst 2000;92(5):397-402.
16. Halfon P, Lindemann ML, Raimondo A, Ravet S, Camus C, Khiri H, et al. 2013. HPV
genotype distribution according to severity of cervical neoplasia using the Digene HPV genotyping
LQ test. Arch Virol. 158:1143-1149.
17. Correnti M, Cavazza ME, Herrera O, Rodríguez A. 2010. Presence of human papillomavirus
infection determined by hybrid capture assay in cervical lesions in a Venezuelan population. Invest
Clin. 51: 27-35.
18. Somogyi L, Malpica Gracián CC, Alvarado B, García M. 2010. Virus del papiloma humano
(VPH) detección y tipificación en la consulta privada. Rev Obstet Ginecol Venez. 70:160-166.
19. López M, Guillén M, Quintero M, Cruz J, Puig J, Toro de Méndez M. 2012. Infección por
virus papiloma humano en pacientes con células escamosas atípicas de un programa de pesquisa de
cáncer cervical. Rev Obstet Ginecol Venez. 72: 19-27.
20. Rivas E, Verlezza S, Flores M. Distribución genotipo-específico del virus papiloma humano
entre hombres y mujeres de Caracas, Venezuela. 2012. Rev Obstet Ginecol Venez. 72:171-176.
21. Correnti M, Medina F, Cavazza ME, Rennola A, Avila M, Fernándes A. 2011. Human
papillomavirus (HPV) type distribution in cervical carcinoma, low-grade, and high-grade squamous
intraepithelial lesions in Venezuelan women. Gynecol Oncol. 121(3):527-531.
22 Sánchez-Lander J, Cortiñas P, Loureiro CL, Pujol FH, Medina F, Capote-Negrín L, et al. 2012.
Human papillomavirus in invasive cervical cancer and cervical intraepithelial neoplasia 2 and 3 in
Venezuela: a cross-sectional study. Cancer Epidemiol. 36: e284-e287.
23. Bernard HU, Chan S, Manos M, Ong CH, Villa L, Delius H, et al. 1994. Identification and
assessment of known and novel human papillomaviruses by polymerase chain reaction amplification,
restriction fragment length polymorphisms, nucleotide sequence, and phylogenetic algorithms. J
Infect Dis. 170:1077-1085.
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105

Toro de Méndez, López de Sánchez
49
24. Saslow D, Solomon D, Lawson HW, Killackey M, Kulasingam SL, Cain J, et al. 2012.
ACS-ASCCP-ASCP Cervical Cancer Guideline Committee. American Cancer Society, American
Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology.
screening guidelines for the prevention and early detection of cervical cancer. CA Cancer J Clin.
62:147-172
25. Ciapponi A, Bardach A, Glujovsky D, Gibbons L, Picconi MA. 2011. Type-specific HPV
prevalence in cervical cancer and high-grade lesions in Latin America and the Caribbean: systematic
review and meta-analysis. PLoS One. 6:e25493.
26. Gage JC, Schiffman M, Solomon D, Wheeler CM, Gravitt PE, Castle PE, et al. 2013.
Risk of precancer determined by HPV genotype combinations in women with minor cytologic
abnormalities. Cancer Epidemiol Biomarkers Prev. 22:1095-1101.
27. Lee EH, Um TH, Chi HS, Hong YJ, Cha YJ. 2012. Prevalence and distribution of
human papillomavirus infection in Korean women as determined by restriction fragment mass
polymorphism assay. J Korean Med Sci. 27:1091-1097.
28. Argyri E, Papaspyridakos S, Tsimplaki E, Michala L, Myriokefalitaki E, Papassideri I, et al.
2013. A cross sectional study of HPV type prevalence according to age and cytology. BMC Infect
Dis. 13:53. doi:10.1186/1471-2334-13-53.
29. Dursun P, Ayhan A, Mutlu L, Çağlar M, Haberal A, Güngör T, et al.2013. HPV types in
Turkey: multicenter hospital based evaluation of 6388 patients in Turkish gynecologic oncology
group centers. Turk Patoloji Derg. 29:210-216.
30. Zhou H, Mody DR, Schwartz MR, Coffey DM, Smith D, Zwain OA, et al. 2014. Genotype-
specific prevalence and distribution of human papillomavirus genotypes in underserved Latino
women with abnormal Papanicolaou tests. J Am Soc Cytopathol 3:42-48.
31. de Jonge M, Busecke G, Heinecke A, Bettendorf O. 2013. Human papillomavirus genotype
distribution in cytologically screened women from northwest Germany. Acta Cytol. 57(6):591-598.
32. Vidal A, Murphy S, Hernandez B, Vasquez B, Bartlett J,Oneko O, et al. 2011. Distribution
of HPV genotypes in cervical intraepithelial lesions and cervical cancer in Tanzanian women.
Infectious Agents and Cancer. 6:20.
33. Clifford GM, Gallus S, Herrero R, Muñoz N, Snijders PJ, Vaccarella S, et al. 2005. IARC
HPV Prevalence Surveys Study Group. Worldwide distribution of human papillomavirus types in
cytologically normal women in the International Agency for Research on Cancer HPV prevalence
surveys: a pooled analysis. Lancet. 366:991-998.
34. de Sanjosé S, Diaz M, Castellsagué X, Clifford G, Bruni L, Muñoz N, et al. 2007. Worldwide
prevalence and genotype distribution of cervical human papillomavirus DNA in women with
normal cytology: a meta-analysis. Lancet Infect Dis.7:453-459.
35. Simonella LM, Lewis H, Smith M, Neal H, Bromhead C, Canfell K. 2013. Type-specific
oncogenic human papillomavirus infection in high grade cervical disease in New Zealand. BMC
Infect Dis.13:114-123.
36. Arbyn M, Benoy I, Simoens C, Bogers J, Beutels P, Depuydt C. 2009. Prevaccination
distribution of human papillomavirus types in women attending at cervical cancer screening in
Belgium. Cancer Epidemiol Biomarkers Prev.18:321-230.
37. Serrano B, Alemany L, Tous S, Bruni L, Clifford GM, Weiss T, et al. 2012. Potential impact
of a nine-valent vaccine in human papillomavirus related cervical disease. Infect Agent Cancer.
7:38-48.
38. Aedo S, Melo A, García P, Guzmán P, Capurro I, Roa JC. 2007. Detección y tipificación
de virus papiloma humano en lesiones preneoplásicas del cuello uterino mediante PCR-RFLP. Rev
Méd Chile. 135:167-173.
39. Derchain SF, Rabelo-Santos SH, Sarian LO, Zeferino LC, de Oliveira Zambeli ER, do
Amaral Westin MC, et al. Human papillomavirus DNA detection and histological findings in
women referred for atypical glandular cells or adenocarcinoma in situ in their Pap smears. Gynecol

50
Oncol. 95:618-623.
40. Katki HA, Schiffman M, Castle PE, Fetterman B, Poitras NE, Lorey T, et al. 2013. Five-year
risks of CIN 3+ and cervical cancer among women with HPV-positive and HPV-negative high-
grade Pap results. J Low Genit Tract Dis. 17:S50-S55.
41. Namugenyi SB, Balsan MJ, Glick SN, Jordan JA. 2013. Prevalence and genotype distribution
of human papillomavirus in cytology specimens containing atypical glandular cells: a case-control
study. J Clin Virol. 58:432-436.
42. Kim SS, Suh DS, Kim KH, Yoon MS, Choi KU. 2013. Clinicopathological significance of
atypical glandular cells on Pap smear. Obstet Gynecol Sci. 56:76-83.
43. Türkmen IÇ, Başsüllü N, Korkmaz P, Günenç B, Baykal CM, Güdücü N, et al. 2013. Patients
with epithelial cell abnormality in PAP smears: correlation of results with follow-up smears and
cervical biopsies. Turk Patoloji Derg. 29(3):179-184.
44. Shoji T, Takatori E, Takeuchi S, Yoshizaki A, Uesugi N, Sugai T, et al. 2014. Clinical significance
of atypical glandular cells in the Bethesda system 2001: a comparison with the histopathological
diagnosis of surgically resected specimens. Cancer Invest. 32:105-109.
45. Zeferino LC, Rabelo-Santos SH, Villa LL, Sarian LO, Costa MC, do Amaral Westin MC, et
al. 2011. Value of HPV-DNA test in women with cytological diagnosis of atypical glandular cells
(AGC). Eur J Obstet Gynecol Reprod Biol. 159:160-164.
46. Massad LS, Einstein MH, Huh WK, Katki HA, Kinney WK, Schiffman M, et al. 2013. 2012
ASCCP Consensus Guidelines Conference. 2012 updated consensus guidelines for the management
of abnormal cervical cancer screening tests and cancer precursors. Obstet Gynecol. 121:829-846.
47. Petry KU, Luyten A, Justus A, Iftner A, Strehlke S, Schulze-Rath R, et al. 2012. Prevalence
of low-risk HPV types and genital warts in women born 1988/89 or 1983/84 -results of WOLVES,
a population-based epidemiological study in Wolfsburg, Germany. BMC Infect Dis. 12:367-375.
ISSN 1390-5740 Número 15 Vol. 1 (2016)
ISSN 2477-9105