
14
Número 16 Vol. 2 (2016)
EVALUACIÓN DE LA TRANSFORMACIÓN DEL ARSÉNICO
CON CEPAS BACTERIANAS AISLADAS DE RELAVES MINE-
ROS, EN EL CANTÓN PONCE ENRÍQUEZ.ECUADOR.
*Anabell Duque-Sarango
1
,* Yolanda Díaz - Heredia
1
,* Gerardo Medina-Ramírez
1
1
Escuela Superior Politécnica de Chimborazo, Facultad de Ciencias, Escuela de Ciencias Químicas.
anabellduque@hotmail.com. ydiaz@espoch.edu.ec. medinag47@gmail.com.
R
esumen
A
bstract
El objetivo del presente estudio fue evaluar la transformación del arsénico utilizando bacterianas
aisladas de relaves mineros del cantón Ponce Enríquez en la provincia del Azuay. A partir de mues-
tras de relaves, se aislaron 47 clones bacterianos que fueron sometidos a pruebas de resistencia al
arsénico, para lo cual se usó como medio de cultivo Agar extracto de levadura-glucosa-oxitetraci-
clina (OGYE) suplementado con arsenito y arsenato a diferentes concentraciones. La capacidad de
oxidación o reducción de arsénico fue evaluada mediante pruebas cualitativas con nitrato de plata. La
caracterización se realizó mediante el sistema de pruebas bioquímicas MICROGEN MID 64 y MID
65. Se obtuvo 8 cepas que resistieron concentraciones de 30 mM de arsenito y arsenato, las cuales
se identicaron como bacilos Gram negativos de los géneros Pseudomona, Vibrio y Pasteurella. El
100% de las bacterias identicadas fueron capaces de reducir el arsenato a arsenito en un período de
5 días. Se concluyó que las bacterias aisladas son extremotolerantes debido a su crecimiento en un
medio con altos niveles de arsénico, que además pueden reducirlo como un mecanismo de detoxi-
cación.
The aim of this study was to assess transformationof arsenic with bacterial strains isolates from mine
tailings at Ponce Enriquez Canton in Azuay province, Ecuador. From tailings samples 47 bacterial
strains were isolated and tested for resistance arsenic, for which it was used as culture medium
Oxytetracycline Glucose Yeast Extract Agar (OGYE) adding arsenic and arsenate in different con-
centrations. Oxidation capacity or reduction of arsenic was assessed by qualitative test with silver
nitrate. The description was performed using biochemical test system with 64 and 65 Microgen
identication (MID). It was obtained 8 strains that resisted 30mM of arsenic and arsenate concentra-
tions, these were identied as a gram negative bacillus from Pseudomonas, Pasteurella and Vibrio.
The 100% of bacteria were able to reduce arsenate to arsenite in a period of 5 days. It concluded that
isolated bacteria are extremotolerant due to its growth on a medium containing high levels of arsenic,
which can also reduce as a detoxication process.
INTRODUCCIÓN
La minería es una actividad que ha causado impactos nega-
tivos a nivel global, debido a las emisiones contaminantes
que alteran ecosistemas terrestres, acuá-
ticos, aéreos, y producen afectaciones en
Palabras claves: Transformación del arsénico, Aislamiento de bacterias, Arsenito, Arsenato.
Keywords: Transformation of arsenic, Isolation of bacteria, Arsenite, Arsenato
Revista Cientíca
ISSN 1390-5740
ISSN 2477-9105
15
Duque, Díaz, Medina
la salud humana. En el sur de Ecuador se
ubica el cantón Ponce Enríquez de la pro-
vincia del Azuay, en el cual existe un
alto número de compañías mineras que
operan permanentemente en la extrac-
ción de oro y plata. La principal fuente de
contaminación en la actividad minera son
los relaves, una mezcla tóxica de rocas,
tierra, agua, minerales y sustancias quí-
micas, que constituyen un subproducto
de procesos mineros, usualmente se com-
ponen de un 50 % de agua (Fundación
Ecológica Arcoíris, 2006).
El arsénico es un metaloide que puede
llegar al agua mediante procesos natura-
les asociados a la composición geológica
del suelo (Manahan, 2007), en algunos
países como Argentina, India, Taiwán y
Vietnam las altas concentraciones de ar-
sénico en el agua se deben a la presencia
natural del metal. Mientras que en países
como Chile, México y China la contami-
nación es causada por actividades antro-
pogénicas como la minería y la quema de
carbón (Ahumada, 2014).
El arsénico se encuentra frecuentemen-
te en el ambiente como compuestos de
As(III) y As(V). Se ha evidenciado que
algunas bacterias pueden oxidar o reducir
el arsénico cuando se encuentran expues-
tas a medios con el metaloide (Muller et
al., 2003; citados en Pacheco et al, 2013).
La capacidad de bacterias para transfor-
mar compuestos de arsénico depende de
la presencia de enzimas redox (Castillo,
2005).
MATERIALES Y MÉTODOS
Sitio de muestreo
Las muestras de relaves mineros se toma-
ron de dos compañías que las representa-
remos como: compañía 1 (C1) y compa-
ñía 2 (C2), ubicadas en el Cantón Ponce
Enríquez, provincia del Azuay (Latitud:
64223; Longitud: 965855), Ecuador.
Aislamiento de bacterias
Tabla 1: Medios de cultivo utilizados para el aislamiento de bacterias
En cada medio (A1, A2, A3 y A4) se inoculó 50 μL de
tres muestras: M1= Muestra líquida de C1; M2= muestra
líquida de C2; y M3= Muestra de lodo de C2. Todos los
cultivos fueron incubados durante 24 horas a tres tempe-
raturas diferentes: 14 °C (temperatura ambiental promedio
de la ciudad de Riobamba durante la investigación); 30 °C,
y; 35 °C, este criterio fue considerado para determinar la
temperatura que permite el mayor desarrollo microbiano.
Se aislaron clones de los medios incubados temperatura
ambiente y 30 °C, los clones que crecieron a 35 °C no
fueron considerados, ya que las posteriores pruebas se rea-
lizaron a temperatura ambiente y el cambio de temperatura
podría afectar su crecimiento.
Determinación de resistencia a arsénico
Se seleccionaron 47 de los clones aislados, y se les repicó
en OGYE con concentraciones crecientes de arsenito y ar-
senato de 5, 10, 15, 20 y 30 mM. Los cultivos se incubaron
a 14 °C durante el tiempo necesario hasta obtener un tama-
ño signicativo de cada clon. El criterio establecido por el
investigador para denir tamaño de los clones, se obtuvo
por comparaciones cualitativas entre los tamaños de los
clones evaluados (Tabla 2).
Tabla 2: Criterio para identicar el tamaño de los clones evaluados
Pruebas de oxidación/reducción
*( Agar extracto de levadura-glucosa-oxitetraciclina)
Los clones que mostraron mayor resistencia al arsénico
fueron inoculados en agua de peptona durante 72h. Pa-
sado este tiempo, los clones fueron centrifugados a 3000
rpm durante 15 minutos, los pellets formados se lava-
Medios de Cultivo Simbología
OGYE* A1
OGYE + NaAsO
2
0,1mM A2
OGYE preparado con el agua de relaves mineros
de la compañía 1
A3
OGYE preparado con el agua de relaves mineros
de la compañía 2
A4
Tamaño de clones Simbología
Clones de tamaño grande (+++)
Clones de tamaño mediano (++)
Clones de tamaño pequeño (+)
Ausencia de crecimiento ( )
16
Número 16 Vol. 2 (2016)
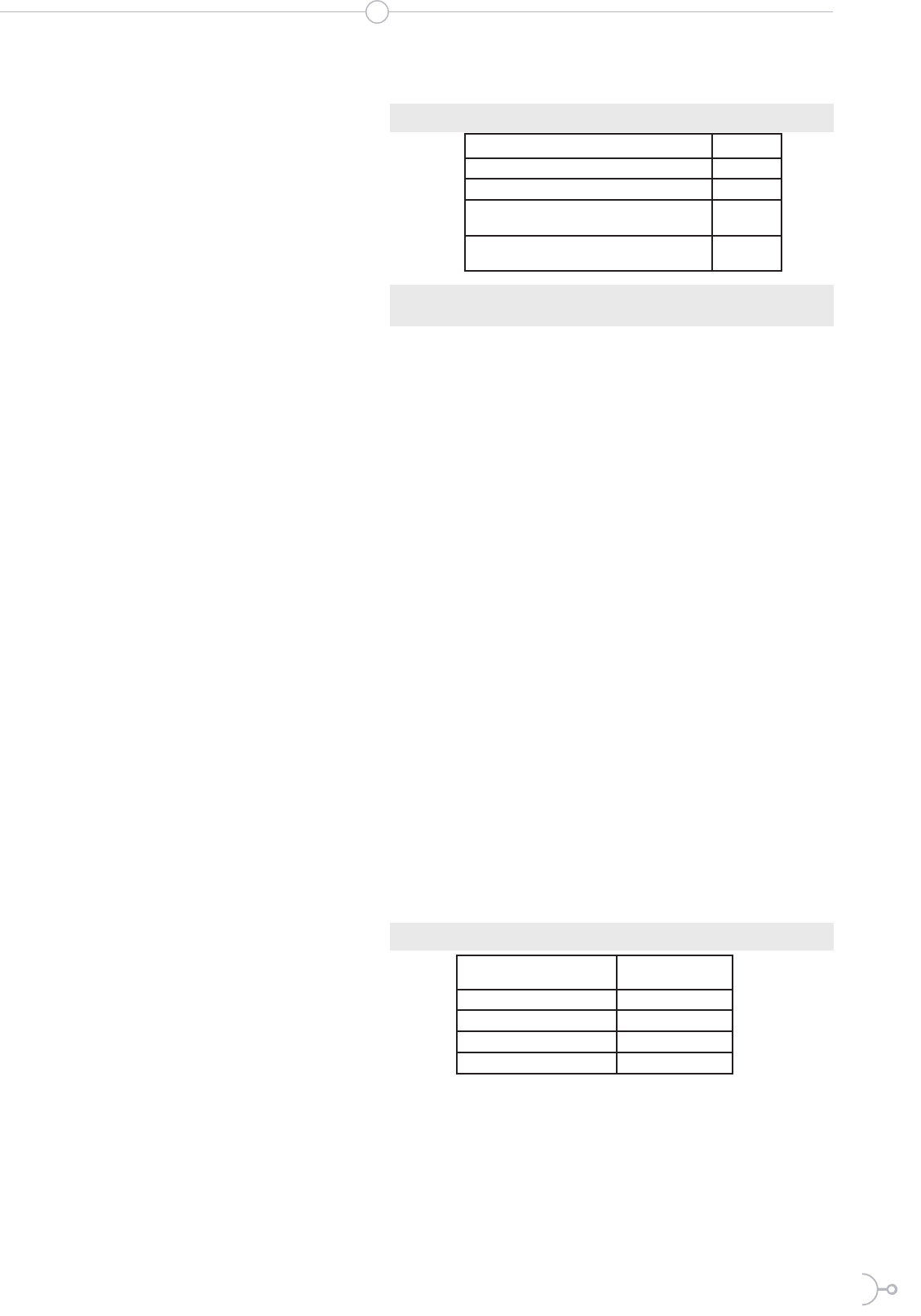
En la Figura 1 se puede apreciar que
existe una importante inuencia de la
temperatura en el desarrollo de los clo-
nes bacterianos aislados, siendo 35 °C la
temperatura donde se encontró mayor
crecimiento y M3 la muestra que más
crecimiento mostró. Farah et al. (2010)
determinaron que la temperatura óptima
de crecimiento para las bacterias resis-
tentes al arsénico Klebsiella oxytoca y
Citrobacter freundii y Bacillus anthra-
cis fue respectivamente 30 °C y 37 °C.
En el presente estudió se obtuvo en ge-
neral un mayor desarrollo bacteriano a
35 °C, sin embargo existieron excepcio-
nes como en el caso de M1 y M2 que
presentaron más crecimiento a 30 °C
que a 35 °C en el medio A3, lo que pare-
ciera indicar que el medio preparado con
el agua de relaves mineros de la compa-
ñía 1 posee algún elemento que favorece
el crecimiento de los clones bacterianos
sobre 30 °C (Tablas 5 y 6).
Se observó una clara preferencia de las
bacterias hacia los medios de cultivo que
tenían arsénico, esta armación se de-
muestra claramente al observar el creci-
miento de los clones en el medio A2, por
lo que se asume que el metaloide aporta
algún tipo de ventaja para su crecimien-
to. También se puede apreciar que en los
cultivos a 30 °C y 35 °C las bacterias se
adaptaron mejor a los medios A3 y A4,
esto puede ser debido a la composición
del agua de los relaves y de la laguna,en
las que, la presencia de otros compues-
tos puede favorecer su desarrollo.
Tabla 3: Criterio de identicación de la actividad de oxidación/reduc-
ción de los clones evaluados
Identicación bacteriana
A las clones más resistentes se les realizó la prueba de
Tinción de Gram y posteriormente fueron identicadas
con las galerías MICROGEN MID 64-MID 65.
RESULTADOS Y DISCUSIÓN
Aislamiento de bacterias
En todas las muestras evaluadas, se observó crecimiento
de bacterias(Tabla 4, 5, 6 ).
Tabla 4: Crecimiento bacteriano en distintos medios a 14 °C.
Tabla 5: Crecimiento bacteriano en distintos medios a 30°C
Tabla 6: Crecimiento bacteriano en distintos medios a 35°C
Figura. 1: Comparación del crecimiento bacteria-
no en los medios OGYE a diferentes temperaturas.
ron con agua desionizada y se resuspendieron en agua
de peptona. De cada resuspención se tomó un inoculó
de 100μL y se colocó en tubos que contenían 200μL de
agua peptonada adicionada con concentraciones de 1mM
y 5mM de arsenito y arsenato. Los cultivos fueron incu-
bados durante 5 y 10 días a 14°C. Al nalizar el tiem-
po de incubación se colocó 200μL de una solución de
AgNO3 0,2M en cada cultivo para determinar la activi-
dad de oxidación/reducción de cada clon, la misma que
se determinó de acuerdo al color del precipitado que se
formó (Simeonova et al. 2004).
Reactivos Color del precipitado
Arsenito + AgNO
3
0,2M Amarillo
Arsenato + AgNO
3
0,2M Marrón
Muestra Medio de cultivo
A1 (UFC/mL) A2 (UFC/mL) A3 (UFC/mL) A4 (UFC/mL)
M1 340 20 0 20
M2 0 20 60 80
M3 1060 2240 580 860
Muestra Medio de cultivo
A1 (UFC/mL) A2 (UFC/mL) A3 (UFC/mL) A4 (UFC/mL)
M1 300 520 2060 1960
M2 220 420 2800 2600
M3 4800 8200 9200 8480
Muestra Medio de cultivo
A1 (UFC/mL) A2 (UFC/mL) A3 (UFC/mL) A4 (UFC/mL)
M1 2260 1060 3200 1320
M2 2400 4400 8400 660
M3 18360 38400 14400 12600
Revista Cientíca
ISSN 1390-5740
ISSN 2477-9105

17
Duque, Díaz, Medina
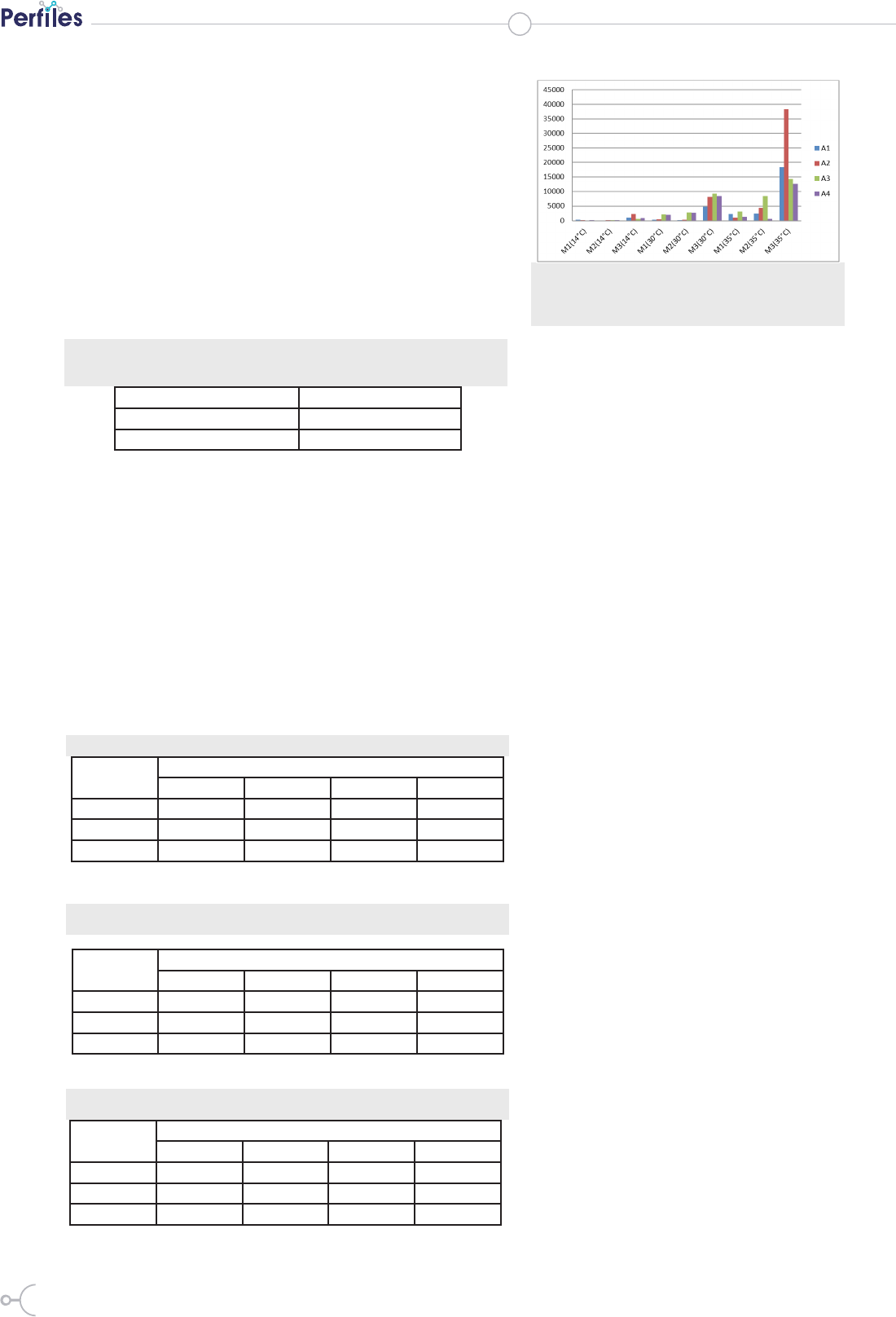
Figura. 2: Crecimiento de bacterias de la mues-
tra M2 en diferentes medios a 30 °C.
Tamaño de los clones aislados: (+++) grande; (++) mediana; (+) pe-
queña; (-) ausencia; celdas en blanco indican que no se realizó repi-
que de las cepas.
Tamaño de los clones aislados: (+++) grande;
(++) mediana; (+) pequeña; (-) ausencia; celdas
en blanco indican que no se realizó repique de
las cepas.
Debido a que nos interesan los clones
resistentes a arsénico, se excluyeron
aquellos que crecieron en el medio A1,
igualmente no se consideró las que cre-
cieron a 35 °C, ya que para pruebas pos-
teriores se usó temperatura ambiente y
el cambio de temperatura podría inhibir
su desarrollo.
En la Figura 2 se observa el crecimiento
de bacterias de la muestra M2 en los 4
medios evaluados a 30 °C. Claramente
se verica que los clones crecieron me-
jor en los medios que contenían arséni-
co, el desarrollo fue incluso mayor en
los medios A3 y A4.
Determinación de la resistencia al ar-
sénico.
De los microorganismos aislados, se se-
leccionaron un total de 47 clones para
evaluar su resistencia a arsenito y arse-
nato: 21 pertenecientes al grupo que se
aisló a temperatura ambiente, y 26 al
grupo aislado a 30 °C. Todas las pruebas
de resistencia se realizaron a temperatu-
ra ambiente (14 °C).
Los resultados obtenidos indican que las bacterias tienen
un mejor desarrollo en arsenato que en arsenito, incluso
en altas concentraciones. Este resultado coincide con el
hecho de que el arsenito es más tóxico que el arsenato
para todo tipo de organismo, según la Agencia para Sus-
tancias Tóxicas y el Registro de Enfermedades (2014).
Los resultados de crecimiento obtenidos (Figuras 1 y 2)
y los valores de resistencia mostrados por los clones ais-
lados parecen indicar que nos encontramos en presencia
de bacterias extremólas, las cuales se desarrollan me-
jor en presencia del arsénico, incluso en concentraciones
mayores a las presentes en los relaves de donde fueron
aisladas (Tablas 7 y 8). Campos et al. en el 2007 y Me-
llado et al. en el 2008 reportaron que cepas de Pseudo-
monas, Enterobacter, Acinetobacter, Burkholderia, Es-
cherichia, fueron capaces de resistir concentraciones de
arsénico mayores a 8 mM. En nuestro caso se lograron
aislar clones capaces de crecer en concentraciones de
hasta 30 mM.
Pruebas de oxidación/reducción de arsénico
Para evaluar la capacidad de oxidación /reducción de ar-
sénico se seleccionaron 8 clones capaces de crecer tanto
en arsenito como arsenato a concentraciones de 30 mM.
(clones 2, 5, 11, 15, 19 de la Tabla 7; clones 21, 22 y 25
Tabla 8 ) y 10 clones resistentes a concentraciones de
20mM (1, 5, 16, 18 de la Tabla 7; 2, 5, 9, 15, 16 y 26 de
la Tabla 8).
Tabla 7: Resultados de la evaluación de la resisten-
cia al arsénico de los clones aislados a temperatura
ambiente.
Tabla 8: Resultados de la evaluación de la resistencia al arsénico de los
clones aislados a 30°C.
18
Número 16 Vol. 2 (2016)
Los resultados obtenidos luego de trascurridos 5 y 10
días, mostraron que en todos los casos los clones eva-
luados fueron capaces de reducir el arsenato en arsenito.
Mellado et al. en el 2008 reportaron que la reducción del
arsenato constituye un importante proceso de detoxica-
ción Esto explicaría el hecho de que todas las cepas eva-
luadas en el presente trabajo, fueron capaces de reducirlo.
Identicación bacteriana
Para la identicación se consideró 8 cepas resistentes a
concentraciones de 30mM de arsenato y arsenito.
Tabla 10: Identicación de las cepas bacterianas aisladas de relaves mi-
neros.
La capacidad de reducción de arsénico
ha sido reportada en varios géneros de
bacterias incluyendo Pseudomonas, En-
terobacter, Acinetobacter, Burkholderia,
Escherichia, entre otros (Campos et al.
2007; Mellado et al. 2008). En este tra-
bajo se aislaron cepas correspondientes a
los géneros Pseudomonas, Vibrio y Pas-
teurella capaces de crecer en elevadas
concentraciones de arsénico y de redu-
cirlo a arsenito.
CONCLUSIONES
En el presente trabajo se aislaron e identi-
caron ocho bacterias a partir de relaves
mineros, seis de ellas correspondieron al
género Pseudomonas, y las dos restantes
a los géneros Vibrio y Pasteurella. Estos
clones fueron capaces desarrollarse en
medios suplementados con concentra-
ciones de 30 mM de arsenito y arsenato.
Se evaluó, a nivel de laboratorio, la capa-
cidad de reducir u oxidar el arsénico en
las cepas bacterianas aisladas, utilizando
un método de detección cualitativo con
nitrato de plata, mediante el cual se obtu-
vo resultados positivos para la reducción
de arsenato a arsenito en todas las cepas
evaluadas.
1. Fundación ecológica arcoiris. 2006. Impactos socioambientales de la minería a los recursos natu-
rales y a la salud humana. Loja : Creativa, 2006.
2. Manahan, Stanley E. Introducción a la química ambiental. D.F. - México. 2007. pp. 152- 155.
3. Ahumada, G. 2014. Arsénico en el agua potable: una preocupación a nivel global. [Internet] 2014.
[Citado el 10 de Octubre 2015.]. Disponible en: http://www.aidis.cl/les/revista-mayo/GAhuma-
Tabla 9: Resultados de las pruebas de oxidación/reducción de arsénico
B
ibliografía
Clones resistentes a 30 mM de arsénico Color de precipitado
2 Amarillo
5 Amarillo
11 Amarillo
15 Amarillo
19 Amarillo
21 Amarillo
22 Amarillo
25 Amarillo
Clones resistentes a 20 mM de arsénico Color de precipitado
1 Amarillo
5 Amarillo
16 Amarillo
18 Amarillo
2 Amarillo
5 Amarillo
9 Amarillo
15 Amarillo
16 Amarillo
26 Amarillo
Aisladas a Temperatura ambiente
Origen
Muestra-Medio
N° Tinción Gram Género
M1-A2 2 bacilos(-)
Pseudomonas sp
M3-A2 10 bacilos(-)
Pseudomonas sp
M3-A2 11 bacilos(-)
Pseudomonas sp
M3-A3 15 bacilos(-)
Vibrio sp.
M4-A4 19 bacilos(-)
Pseudomonas sp.
Aisladas a 30°C
M3-A2 21 bacilos(-)
Pseudomonas sp.
M3-A3 22 bacilos(-)
Pseudomonas sp.
M3-A4 25 bacilos(-)
Pasteurella sp
Revista Cientíca
ISSN 2477-9105

19
da-Arsenico2014.pdf.
4. Pacheco G, Mondragón V, Velázquez J. Oxidación del arsénico regulada por un sistema bacteriano
de dos componentes. Revista Bio Ciencias. 2013; 2(3): 92-97.
5. Castillo, F. 2005. Biotecnología Ambiental. [Internet] 2005. [Citado el 11 de Octubre 2015]. Dis-
ponible en: https://books.google.com.ec/books?id=19ffPAm3E3kC&printsec=frontcover&hl=es&-
source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false.
6. Farah R, Iram, Rehman A, Shakoori R. Isolation and characterization of arsenic reducing bacteria
from industrial efuents and their potential use in bioremediation of wastewater. [Internet] 2010. [Ci-
tado el 23 de Octubre 2015]. Disponible en: https://www.researchgate.net/publication/258022850_
Isolation_and_Characterization_of_Arsenic_Reducing_Bacteria_from_Industrial_Efuents_and_
their_Potential_Use_in_Bioremediation_of_WastewateR
7. Agencia para sustancias tóxicas y el registro de enfermedades. 2014. Arsénico. [Internet] 2014.
[Citado el 7 de Octubre 2015.]. Disponible en: http://www.atsdr.cdc.gov/es/toxfaqs/es_tfacts2.ht-
ml#bookmark1.
8. Campos V, Valenzuela C, Alcorta M, Escalarte G, Mondaca M. Aislamiento de bacterias resisten-
tes a Arsénico desde muestras de rocas volcánicas de la quebrada camarones. Chile. [Internet] 2007.
[Citado el 17 de Octubre 2015]. Disponible en: http://www.scielo.cl/scielo.php?script=sciarttext&pi-
d=S0717-65382007000200003.
9. Mellado C, Badilla C, Escalante G, Campos V, Mondaca M. Transformación de arsénico por bac-
terias aisladas de sedimentos enriquecidos con el metaloide. Anidad. 2008; LXV: 115-119.