
R
esumen
A
bstract
81
BIORREMOCIÓN DE PLOMO EN SOLUCIÓN POR FIBRAS DE
FURCRAEA ANDINA Y BIOPELÍCULAS DE PSEUDOMONAS AERUGINOSA
Anita-Ríos
1
, Roque-García
2
, Víctor García
1
, Cecilia García
3
Universidad Nacional de Chimborazo, Ecuador
1
, Escuela Superior Politécnica de Chimborazo
2
,
Pontificia Universidad Católica, Ecuador
3
El objetivo de esta investigación fue estudiar la biorremoción de plomo en solución por fibras de F. andina y
fibras de F. andina con biopelículas de P. aeruginosa en su superficie. Para lograr nuestro objetivo: (1) Se aisla-
ron y diferenciaron P. aeruginosa de muestras de sedimentos contaminados. (2) Se extrajeron fibras naturales
de F. andina y se caracterizaron. (3) Se crecieron biopelículas de P. aeruginosa en la superficie de las fibras de
F. andina. (4) Se evaluó la cantidad más pequeña que se necesita de plomo para inhibir el crecimiento de P.
aeruginosa en estado plantónico y en biopelículas. (5) Se evaluó el potencial de remoción de plomo de fibras
de F. andina y de F. andina más biopelículas. Nuestros resultados confirman que la concentración mínima
de plomo (aprox. 500 mg L
-1
) que inhibe sustancialmente el crecimiento de P. aeuruginosa es alrededor de
5 veces superior cuando las células de P. aeuruginosa se encuentran formando una biopelícula, cuando se
compara con la concentración mínima inhibitoria del crecimiento de células en su estado plantónico (aprox.
200 mg L
-1
). En los dos casos estudiados, el plomo en suspensión con una concentración inicial de 50 mg L
-1
fue removida en un 99,99 % en 2 horas. Sin embargo, la presencia de la biopelícula de P. aeuruginosa acele-
ró el proceso de remoción, consiguiendo que alrededor del 90% de la cantidad inicial fuese adsorbida en la
EPS y fibras durante la primera hora de tratamiento. La mayor tasa de remoción de Plomo en suspensión se
obtuvo cuando el cociente que resulta de dividir la cantidad de fibra (expresada en gramos) entre el volumen
del contenedor (expresado en mL) es aproximadamente igual a 0,15. El empleo de fibras naturales (P. andina)
en conjunto con biopelículas de P. aeuroginosa resultan una alternativa eficiente, simple y económica para la
biorremoción de plomo en suspensión.
Palabras claves: adsorción, biorremoción, fibras naturales, plomo.
The objective of this research was to study the bioremoval of lead in solution by fibers of F. andina and fibers
of F. andina with biofils of P. aeruginosa on its surface. To achieve our objective: (1) P. aeruginosa were iso-
lated and differentiated from contaminated sediment samples from an aquaculture plant. (2) Natural fibers
were extracted from F. andina and characterized. (3) P. aeruginosa biofilms were grown on the surface of F.
andina fibers. (4) The smallest amount of lead required to inhibit the growth of P. aeruginosa in planktonic
state and in biofilms was evaluated. (5) The lead removal potential of fibers F. andina and F. andina plus bio-
films of P. aeruginosa was evaluated. Our results confirm that the minimum lead concentration (about 500
mg L
-1
) that substantially inhibits the growth of P. aeuruginosa is about 5 times higher when P. aeuruginosa
cells form a biofilm when compared to the minimal inhibitory concentration of the cell growth in its plank-
tonic state (approx. 200 mg L
-1
). In the two cases studied, lead in suspension with an initial concentration
of 50 mg L
-1
was removed by 99.99% in 2 hours. However, the presence of the biofilm of P. aeuruginosa
accelerated the removal process, obtaining about 90% of the initial amount adsorbed in the EPS and fibers
during the first hour of the treatment. The highest removal rate of lead in suspension was obtained when the
ratio resulting from dividing the amount of fiber (expressed in grams) between the volume of the container
(expressed in mL) is approximately equal to 0.15. The uses of natural fibers (P. andina) together with biofilms
of P. aeuroginosa are an efficient, simple and economical alternative for the bioremoval of lead in suspension.
Key words: adsorption, bioremoval, agave, lead.
Ríos, García, García, García
Fecha de recepción: 05-04-2917 Fecha de aceptación: 02-06-2017

82
INTRODUCCIÓN
Uno de los retos de la Tecnología Ambiental actual es
el desarrollo de procesos de bioremediación de fácil
acceso, desde el punto de vista técnico y económico.
La biorremediación se fundamente en el empleo de
microorganismos, plantas, o las enzimas derivadas de
ellos para retornar a un medio sea agua, suelo u aire
que ha sido alterado por contaminantes a su condición
natural. El termino biorremediación usualmente
comprende degradación de la naturaleza de elementos
contaminante, pero este no se aplica a metales pesados
ya que su naturaleza química no pueden ser degradada.
Sin embargo, los metales pesados pueden ser adsorbidos
o alternativamente, se puede cambiar su estado de
oxidación a uno menos contaminante. Así, los metales
pesados no son degradados por plantas, pero si pueden
ser adsorbidos y removidos del medio que contaminan.
En la biorremoción se usan microorganismos, plantas,
o las enzimas derivadas de ellos para remover elementos
y extraerlos del medio contaminado (1). Los metales
y metaloides suponen una de las amenazas al medio
ambientales de mayor relevancia en la actualidad. Se
estima que la toxicidad total de estos, por el elevado
volumen en que se vierten, es incluso mayor que la de
los residuos radioactivos y orgánicos juntos (2). Las
presencias de metales pesados en el medio ambiente tienen
diversos orígenes. Principalmente actividades de minería
y agricultura, y, en menor medida, procesos industriales,
combustibles y aguas urbanas (3). Sin embargo, los
metales más tóxicos son producidos por la industria
del metal, minera y manufacturera (4). La toxicidad de
esos elementos se incrementa debido a su capacidad de
bioacumularse y transferirse a través de la cadena trófica.
A partir de ciertas concentraciones, pueden ocasionar
efectos nocivos en la salud de los humanos (problemas
en el desarrollo embrionario e infantil, alteraciones en la
reproducción, daños neuronales, etc.) (5). El plomo es uno
de los metales pesados que suscita mayor preocupación,
tanto por el volumen en que es liberado al medio
ambiente, como por su toxicidad y persistencia. Según la
“Environmental protection agency (EPA) de los Estado
Unidos de Norte América” el nivel permisible de Pb en el
agua potable es 0,015 mg L
-1
(6). Por tanto, para tratar aguas
contaminadas con plomo se requieren métodos altamente
efectivos. Los mecanismos involucrados en la remoción
de contaminantes son de tres tipos: físicos, químicos y
biológicos. En un proceso de bioremediación pueden
darse varios simultáneamente. Entre las alternativas para
la remoción de metales pesados en soluciones acuosas se
pueden incluir: el intercambio iónico, la
precipitación química, ósmosis inversa,
procesos electroquímicos y la retención
de una sustancia por otra cuando están
en contacto (sorción) (5,7).
Cuando los contaminantes están disper-
sos en un medio como el suelo, es nece-
saria una etapa previa para movilizarlos.
En este contexto la fitorremediación (en
conjunto o no con el uso de microor-
ganismos) es una opción de bajo coste
muy interesante (8). La fitorremediación
consiste en el empleo de la capacidad de
ciertas plantas de acumular metales y, en
algunos casos, de mineralizarlos o vola-
tilizarlos. Cuando una planta tiene una
alta capacidad de acumulación de me-
tales se la denomina hiperacumuladora.
Este término puede llevar a engaño, ya
que la capacidad de remoción de estas
plantas es marginal si se la compara con
carbones activos o biomasas bacteria-
nas o lignocelulósicas. Por ejemplo, en el
caso del plomo una remoción de tan solo
1 mg g
-1
es necesaria para considerar a
una planta como hiperacumuladora.
Otro inconveniente de la fitoremedia-
ción es la gran cantidad de biomasa ne-
cesaria para la eliminación de los conta-
minantes y que el tiempo necesario para
la remoción es normalmente de meses o
años. Por sus características, las técnicas
de fitoremediación son útiles cuando no
existe riesgo de que los contaminantes se
trasladen o filtren a superficies extensas
y cuando existen niveles bajos de conta-
minantes.
En la * Tabla 1 se listan algunas ventajas
y desventajas de los principales métodos
de remoción de metales.
La mayoría de estos procesos tienen
como inconveniente su alto costo,
ya que precisan una importante
inversión inicial en equipamiento y/o
tienen costos operacionales altos. Los
procesos que involucran adsorción del
contaminante son muy prometedores
ISSN 1390-5740 Número 17 Vol. 1 (2017)
ISSN 2477-9105

83
debido su versatilidad, eficacia y bajo
coste. El empleo de carbón activado
es muy eficiente, sin embargo, en los
últimos años el interés se ha desplazado
a los adsorbentes de origen vegetal (por
ejemplo: fibra de coco, fibra de trigo,
polvo de tabaco, piel de plátano, etc.)
(9). Otra de las ventajas que destaca en
los absorbentes de origen vegetal, es
lo simple que puede ser el proceso de
desorción, el cual, normalmente consiste
en una disminución del pH mediante
adición de HCl (11).
Además, del empleo de subproductos
vegetales, biomasa de origen microbio-
lógico y biopelículas “biofilm” han sido
propuestos en procesos de remoción de
metales (12). Las biopelículas (tapiz bac-
teriano) se forma cuando células plantó-
nicas se adhieren a una superficie o sus-
trato, formando una comunidad, que se
caracteriza por la existencia de una ma-
triz extracelular mucilaginosa y protectora, que sirve de
soporte a la estructura tridimensional de la biopelícula.
Esta matriz está formada entre otras cosas por exopolisa-
cáridos o sustancias poliméricas extracelulares (EPS). Los
EPS son macromoléculas de carbohidratos que son sinte-
tizadas por enzimas bacterianas que son excretadas por
las células que se acumulan extracelularmente. Por ejem-
plo, la eliminación de Cu, Cd y Pb por medio de biomasa
inactivada de Aspergillus niger resultó ser más efectiva
que la adsorción empleando carbón activo (F-400) (13).
Los EPS actúan como un polímero orgánico y compren-
den una gran variedad de moléculas orgánicas, tanto de
alto peso molecular, como de moléculas pequeñas (14). La
función de la matriz de EPS es la de proteger las células de
entornos adversos y facilitar su supervivencia. Entre otros
procesos, la matriz influye en la degradación de material
particulado, adsorción de nutrientes, reducción del es-
tado de oxidación de moléculas y adsorción de metales.
En general, cuando se emplean microorganismos como
adsorbentes el proceso es conocido como biosorción. Por
ahora, los mecanismos exactos de biosorción de metales
pesados no han sido totalmente clarificados. Lo que sí pa-
rece estar claro, es que no existe un único mecanismo,
* Tabla 1. Ventajas y desventajas de los principales métodos de remoción de metales
Adaptada de Volesky (10).
Ríos, García, García, García
PROCESO VENTAJAS DESVENTAJAS
Precipitación / Filtración
Simplicidad
Baja efectividad
Produce lodo
No aplicable a bajas concentraciones
Oxidación / Reducción química
Permite la recuperación del metal
Requiere sustancias químicas
No aplicable a bajas concentraciones
Alto Coste
Oxidación / Reducción biológica
Bajo coste
Ósmosis inversa
Permite concentrar metales Alto coste operacional y de inmovilizado
Intercambio iónico
Efectividad Alto coste
Permite la recuperación del metal Problemas con material particulado
Adsorción
Bajo coste
Baja efectividad para ciertos metales
(depende del adsorbente)
Multitud de opciones
(tantas como adsorbentes)
Evaporación
Simplicidad
Requiere energía
Alto coste
Produce lodo
Fitorremediación
Permite tratar suelos directamente No aplicable a altas concentraciones
Bajo coste Produce gran cantidad de biomasa
Aplicable a bajas concentraciones Tiempos de tratamiento de meses

84
debido entre otras razones, a que en ambientes acuosos
los metales están presentes en diferentes formas. Así, por
ejemplo, pueden encontrarse disueltos o particulados, en
forma iónica libre, complejados, etc.
La biosorción se distingue de la bioacumulación en que
en esta segunda se producen procesos de activos de
transporte. La biosorción puede ser definida como la
habilidad de ciertas biomoléculas o biomasas de unirse a
contaminantes. De esta manera, los procesos de biosorción
pueden usar tanto biomasas vivas como inactivadas o,
incluso, productos obtenidos de la biomasa (por ejemplo,
EPS). El problema principal del uso de microorganismos
vivos es el efecto tóxico que altas concentraciones de
contaminantes puedan tener para ellos, ya que el sistema
requeriría del suministro constante de nueva biomasa.
La respuesta ante el elemento tóxico depende de la cepa
del microorganismo en cuestión y de la aclimatación
previa. Estudios recientes, han mostrado que las cepas
microbianas aisladas de ambientes contaminados tienen
una mayor capacidad de resistencia ante metales y son
más efectivas en procesos de descontaminación (12).
Además, el empleo de biopelículas resulta interesante
porque permite simultáneamente la remoción de una am-
plia variedad de contaminantes, incluyendo materia or-
gánica, nitratos, sulfatos, compuestos orgánicos, metales,
entre otros (15,16). Más recientemente, Mayacela Rojas et
al. (2017) han mostrado la alta capacidad de remoción de
Cu, Zn, Cd y Pb en suspensión que exhiben las fibras de
P. andina. (17).
El objetivo de esta investigación fue estudiar la biorre-
moción de plomo en solución por fibras de F. andina y
fibras de F. andina con biopelículas de P. aeruginosa en
su superficie.
MATERIALES Y MÉTODOS.
Para lograr nuestro objetivo: (1) Se aislaron y diferencia-
ron P.aeruginosa de muestras de sedimentos contamina-
dos provenientes de una planta acuícola. (2) Se extrajeron
fibras naturales de F. andina y se caracterizaron. (3) Se
crecieron biopelículas de P. aeruginosa en la superficie
de las fibras de F. andina. (4) Se evaluó la cantidad más
pequeña que se necesita de plomo para inhibir el creci-
miento de P. aeruginosa en estado plantónico (libres en
suspensión) y en biopelículas. (5) Se evaluó el potencial
de remoción de plomo de fibras de F. andina y fibras más
biopelículas de P. aeruginosa.
Para la obtención y aislamiento de P.
aeruginosa se recolectó cerca de 1 kg de
sedimentos de una planta acuícola (An-
des ecuatorianos) en botes plásticos de
polipropileno, previamente tratados con
HCl 0,1 M para eliminar posibles impu-
rezas y esterilizados a 121ºC durante 15
minutos. A partir de una muestra de 1
mL de sedimentos, se realizaron dilucio-
nes hasta 10
-6
previa agitación vigorosa
con agitador Vortex. P. aeruginosa fue-
ron selectivamente aisladas y diferencia-
das usando un agar de aislamiento de
Pseudomonas DIFCO
TM
con glicerol.
Una vez aisladas fueron cultivadas a 32
ºC en condiciones anóxicas (ausencia
de oxígeno puro en la forma de O
2
) con
la presencia de nitratos (NO
3
) como
agentes de oxidación y glicerol (C
3
H
8
O
3
)
como fuente de carbono en el proceso
de fermentación y fomentación del
crecimiento bacteriano.
Se extrajeron fibras naturales de hojas
de la planta de la especie F. andina. Esta
fibra, nativa de la Región Andina, es de
fácil obtención y su extracción origi-
na un bajo impacto ambiental. Inicial-
mente se procedió al corte y recolección
de hojas maduras, desfibrado manual
observando que las fibras se encontra-
ban correctamente desfibradas, lavado
asegurando que existía un máximo de
2% de pulpa adherida a la fibra y secado
de las fibras. Antes de su uso, las fibras
se secaron en estufa a 75ºC durante 24
horas y se dosificaron en términos del
peso requerido. De esta manera se lo-
grando hazes de fibras exhibieron las
siguientes dimensiones (valores pro-
medios aproximadamente): el diámetro
D= 0,0002m y la longitud L=0,2m; un
volumen V=0,0000000251m
3
y una su-
perficie total S=0,000126m
2
, con una
superficie específica S
e
=5005m
-1
(16).
En la literatura se reporta que la com-
posición de las fibras de F. andina es
(aproximadamente) un 73% de celulosa,
un 1,90% de resinas, ceras y grasas, un
ISSN 1390-5740 Número 17 Vol. 1 (2017)
ISSN 2477-9105

85
11,30% de lignina y 10,50% de (18,19)
pentosanos.
Se evaluó la cantidad más pequeña que
se necesita de plomo para inhibir el
crecimiento de P. aeruginosa en estado
plantónico (libres en suspensión) y en
biopelículas: (1) Para el estudio de inhi-
bición del crecimiento de bacterias libres
en suspensión, se tomó 0,5 mL de una
suspensión con concentración de bacte-
rias conocida (OD
650
=0,5) y se añadió a
tubos de cultivo con diferentes concen-
traciones de nitrato de plomo (1; 0,5; 0,2;
0,1; 0,05 g L
-1
) y 100 mM de NaCl. Para
determinar la concentración mínima in-
hibitoria del crecimiento de P. aerugino-
sa, se midió la densidad óptica de la sus-
pensión a una longitud de onda de 650
nm (OD
650
) una vez que han transcurri-
do 24 horas después de haber añadido
las bacterias a los tubos de cultivo con
diferentes concentraciones de nitrato de
plata. (2) Para el estudio de la inhibición
del crecimiento de baterías en biopelícu-
las, se empleó una biopelícula formada
sobre agar (Culture Agar, DIFCO
TM
, su-
ministrados por Fisherscientific, Hamp-
ton, New Hampshire, Estados Unidos)
en placas Petri con número similar de
bacterias al usado en el ensayo con célu-
las en estado plantónico (Determinado
previamente). Todo la biopelícula fue re-
tirada y suspendida en solución de NaCl
(100 mM); la concentración de bacterias
se determinó a través de la medida de
densidad óptica. La biopelícual fue ex-
puesto a las mismas soluciones de nitra-
to de plomo especificadas previamente.
Una vez trascurrido 24 horas, la solución
fue retirada y sustituida por otra de NaCl
(100 mM). La biopelícula fue removida,
la solución con la biopelícula fue homo-
geneizada y luego se procedió a medir su
densidad óptica.
El porcentaje de inhibición del creci-
miento de las bacterias, fue calculado de
la siguiente manera:
(1)
donde DO es la densidad óptica medida en la suspensión
de bacterias a una longitud de onda de 650 nm.
Para la evaluación del potencial de remoción de plomo de
fibras de F. andina y fibras más biopelículas de P. aerugi-
nosa. Se prepararon soluciones con diferentes concentra-
ciones de plomo, disolviendo nitrato de plomo en agua
destilada (50 mg L
-1
). Los ensayos de biorremoción de
plomo fueron realizados en tubos de cultivo de 10 mL en
los que se introdujeron diferentes cantidades (expresadas
en gramos) de fibras de F. andina. Además, se realizaron
ensayos empleando cultivos de P. aeruginosa que fueron
añadidos 24 horas antes para permitir la formación de
biopelículas. Luego, la solución acuosa se sustituyó por
la solución con diferentes concentraciones de Plomo. La
determinación de Plomo se realizó empleando un espec-
trómetro de Absorción Atómica (PerkinElmer 1100, Wal-
tham, Massachusetts, Estados Unido). Para la determina-
ción de plomo las muestras previamente se centrifugaron
y filtraron (0,45 micras).
RESULTADOS Y DISCUSIÓN
La Figura 1 incluye los resultados obtenidos en los ensa-
yos realizados para determinar la concentración mínima
inhibitoria del crecimiento de P. aeruginosa. Se ensaya-
ron soluciones con concentraciones de plomo entre 50
y 1000 mg
•
L
-1
. En el caso de P. aeruginosa en su estado
plantónico se encontró un importante porcentaje de in-
hibición del crecimiento de las células incluso cuando la
concentración de Plomo fue de 50
•
mg L
-1
. Los resultados
sugieren que la disponibilidad de nutrientes tuvo un lige-
ro efecto positivo aun cuando las concentraciones de Plo-
mo fue de 50 y 100 mg
•
L
-1
. En el caso del biopelículas de P.
aeruginosa, la biopelícula aporta un importante grado de
protección a las células, así, hasta concentraciones de 200
mg
•
L
-1
, el porcentaje de inhibición registrado fue menor
de un 20%. Resultados similares, que resaltan el efecto
protector de la matriz de EPS que integra la biopelícula,
fueron reportados por Teitzel y Parsek (20). Esto autores
encontraron que la concentración de Plomo mínima in-
hibitoria del crecimiento de P. aeruginosa fue hasta dos
veces mayor en células que se encontraban formando bio-
películas, cuando se comparó con la concentración mí-
nima inhibitoria del crecimiento de células en su estado
plantónico. Por otro lado, para concentraciones de Plomo
Ríos, García, García, García
I % =
DO
&'()
− DO
&'+,)
DO
&'()
· 100
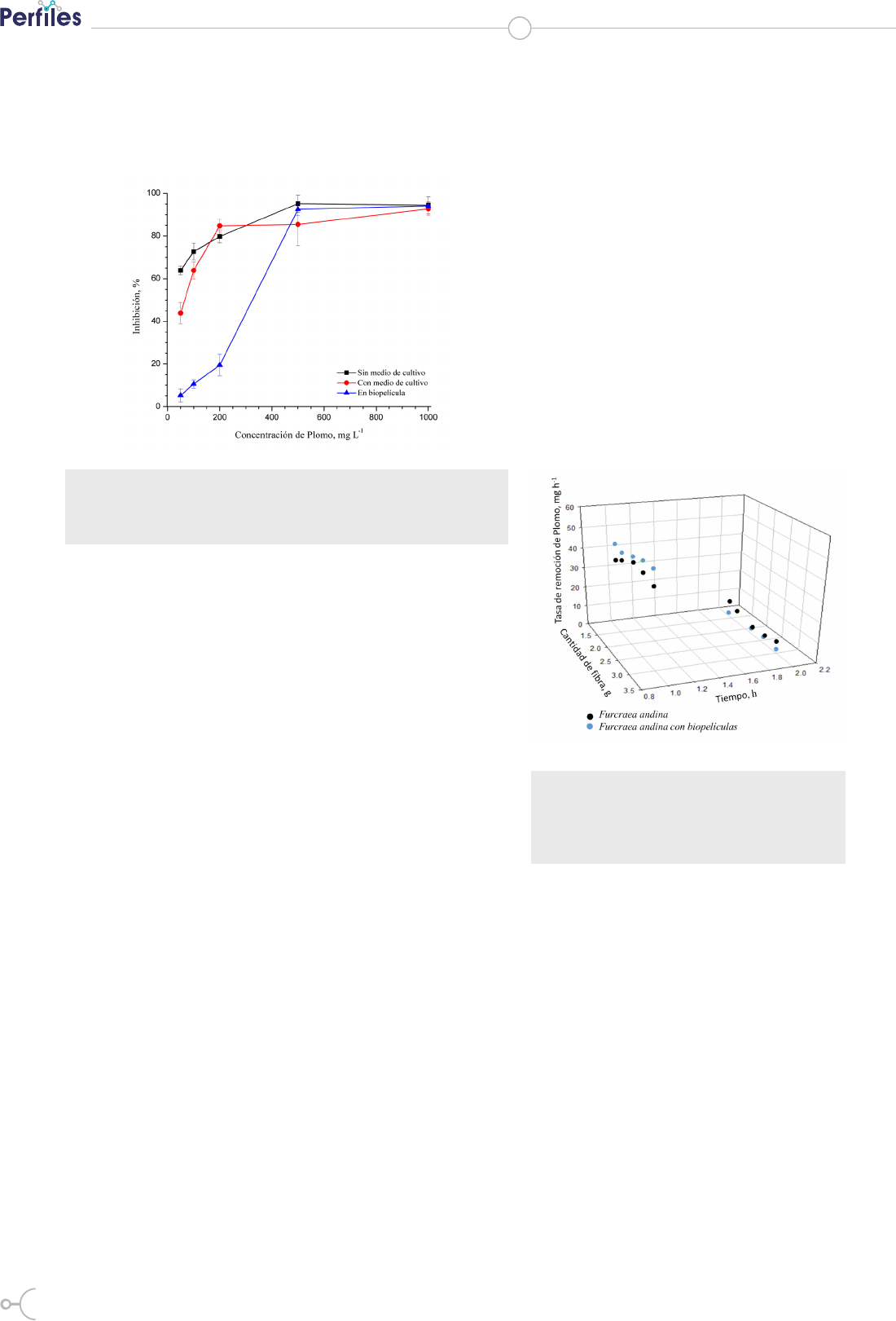
86
de 500 y 1000 mg
•
L
-1
, prácticamente todas las bacterias
experimentaron el efecto tóxico del Plomo independien-
tes del estado en que se encontraban. Película
Figura 1. Valores relativos de la inhibición del crecimiento
de P. aeruginosa en estado plantónico y formando biopelícu-
las, en soluciones con diferentes concentraciones de Plomo.
Aunque todos los microorganismos son sensibles a los me-
tales pesados, su desarrollo y proliferación en ambientes
contaminados puede llevar a la aparición de cepas más
resistentes. Las bacterias del género P. aeruginosa son de
gran interés para los procesos de biorremediación por su
alta resistencia a metales pesados y su capacidad de adap-
tarse a diferentes ambientes y modos nutricionales (21). La
cepa de P. aeruginosa aislada en este estudio exhibió valo-
res aceptables de tolerancia del plomo existente en solución
a diferentes concentraciones. Estos valores de tolerancia
del Plomo la hacen un candidato potencial para el diseño
de procesos de bioremediación y biorremoción de Plomo.
En un estudio similar, Ceylan y Ugur encontraron que las
concentraciones de Plomo mínimas de inhibición del cre-
cimiento de P. fluorescens y P. putida fueron de alrededor
de 2000 y 500 mg L-1, respectivamente (22).
La Figura 2 muestra la tasa de remoción de Plomo — cantidad
de plomo removida por unidad de tiempo — de la solución en
función del tiempo y de la cantidad de fibras de F. andina. En
la Figura 2, se incluyen los resultados de los ensayos realizados
con biopelículas de P. aeruginosa. La concentración inicial de
50 mg
•
L
-1
de plomo fue removida en un tiempo de 2 horas en
todos los casos. La cantidad de fibra no tuvo influencia en la
tasa de remoción de plomo, sugiriendo que la menor cantidad
ensayada es suficiente para la remoción del plomo. La presen-
cia de la biopelícula aceleró el proceso de remoción de plomo,
consiguiendo que alrededor del 90% de la cantidad inicial fuese
adsorbida en la EPS y fibras durante la primera hora de trata-
miento. En la Figura 3, se ilustra como varia
la tasa de remoción de Plomo en función de
la cantidad de fibra natural utilizada.
En la Figura 3 se puede observar un valor alto
de la tasa de remoción de Plomo por unidad
de tiempo cuando la cantidad de fibra na-
tural utilizada fue de 1,5 g (recordemos que
esta cantidad de fibra se colocó en un con-
tenedor que tenía volumen de 10 mL). Los
resultados sugieren que la tasa de remoción
de Plomo es sustancialmente alta cuando el
cociente que resulta de dividir la cantidad de
fibra (expresada en gramos) entre el volumen
del contenedor (expresado en mL) es menor
o igual a 0,15.
Figura 2. Tasa de remoción de Plomo en
función del tiempo y de la cantidad de fibras
de F. andina para ensayos realizados con o
sin biopelícula de P. aeruginosa.
La capacidad de las fibras naturales para
la adsorción de contaminantes está liga-
da a la estructura interna y a la compo-
sición. Para ser usadas en procesos de
bioremediación, es muy importante la
superficie específica de la fibra, es decir,
la superficie por unidad de volumen de
fibra utilizada, que cuanto mayor sea,
mayor velocidad de adsorción de conta-
minantes tendrá y, que será aún mayor
en el caso de emplear biopelículas, pues
mayor cantidad de bacterias podrá so-
portar.
ISSN 1390-5740 Número 17 Vol. 1 (2017)
ISSN 2477-9105

87
Figura 3. Máxima remoción de plomo frente
a la cantidad de fibra para los ensayos rea-
lizados con fibras de F. andina y con fibra
más biopelícula de P. aeruginosa.
En la remoción de metales pesados se
han empleado históricamente un gran
número de fibras y biomasas obtenidas
de diferentes fuentes (normalmente de
plantas ligno-celulósicas). La lignina es
un polímero natural de estructura com-
pleja, no soluble en agua y que presenta
ramificaciones tridimensionales y nu-
merosos grupos hidroxilos. El conteni-
do de lignina en las fibras influencia la
estructura interna y externa. Debido a la
alta área superficial (180 m
2
g
-1
) de esta,
las fibras naturales con un alto contenido
en lignina son adecuadas para procesos
de biorremoción. En este caso, F. andina
con un 10% de lignina en su composición
es un candidato muy adecuado para este
tipo de procesos. Uno de los problemas
cuando las fibras tienen un alto conteni-
do en lignina es que esta molécula puede
inhibir el crecimiento de microorganis-
mos. Sin embargo, en un trabajo previo,
la cepa aislada de P. aeruginosa se adhirió
sin problemas a este soporte, mostrando
incluso velocidades mayores de adhesión
que los observados en sustratos de polie-
tileno tereftalato (PET) u otras fibras na-
turales (23).
Generalmente, los resultados obtenidos
en ensayos de adsorción con biomasas
son muy dispares, ya que en muchas
ocasiones se emplean diferentes grados de molienda para
la biomasa (aumentando la superficie específica al dis-
minuir el tamaño de partícula y, por tanto, la velocidad
de adsorción) e incluso niveles de mezcla mecánica. En
el caso del presente estudio, los ensayos se realizaron en
condiciones estáticas (una solución contaminada con Plo-
mo en un contenedor) y con la fibra sin moler. Estas son
condiciones que se pueden considerar muy desfavorables,
aunque también, son las condiciones que más se asemejan
a las de operación en procesos de biorremoción, donde
el factor económico y operacional son determinantes. En
particular, para la remoción de plomo se han reportado
valores desde 10 hasta 300 mg h
-1
g
-1
(24,25). Los valores
máximos obtenidos en este estudio se ubicaron alrededor
de los 40 mg h
-1
g
-1
(Figura 3).
Cuando se emplean microorganismos vivos para la remo-
ción de metales, los mecanismos son diversos y comple-
jos. Sin embargo, se sabe que esta remoción ocurre en al
menos dos etapas: una primera fase de biosorción, la cual
es la más rápida (esta puede darse también con biomasas
inactivadas) y una segunda, más lenta, dependiente del
metabolismo celular (26). Aunque esta segunda etapa es
responsable de un porcentaje más pequeño de remoción,
el uso de biopelículas vivos presenta otras importantes
ventajas que pueden redundar en un mejor sistema de
biorremoción. Por ejemplo, Chang et. al (27), empleando
biomasas de P. aeruginosa, encontraron casi un 40% de
mejora en la remoción de plomo cuando se usaron bio-
masas vivas en lugar de inactivadas.
Además, el uso de microorganismos mejora la capacidad
del sistema de soportar ciclos de adsorción/desorción, por
lo que la vida útil del sistema de remoción aumenta con-
siderablemente. En el caso de P. aeruginosa se han repor-
tado la ejecución de hasta 4 ciclos de adsorción/desorción
con solo un 20% de pérdida de capacidad de remoción del
plomo (27). Como ventaja adicional, en contraste con los
métodos químico-físicos, el uso de biopelículas vivos per-
mite simplificar el proceso, ya que los microorganismos
se producen in situ y son capaces, a la vez, de eliminar a
través de su metabolismo otros contaminantes como por
ejemplo materia orgánica.
Los resultados muestran el gran potencial que tiene el uso
de fibras naturales de F. andina conjuntamente con bio-
películas de P. aeruginosa en procesos de biorremoción
de plomo en aguas contaminadas.
Ríos, García, García, García

88
CONCLUSIONES
La concentración mínima de plomo (aprox. 500 mg L
-1
) que
inhibe sustancialmente el crecimiento de P. aeuruginosa es
alrededor de 5 veces superior cuando la células de P. aeuru-
ginosa se encuentran formando una biopelícula y cuando se
compara con la concentración mínima inhibitoria del creci-
miento de células en su estado plantónico (aprox. 200 mg L
-1
).
En los dos casos estudiado, el plomo en suspensión con una
concentración inicial de 50 mg
•
L
-1
fue removida en un 99,99
% en 2 horas. Sin embargo, la presencia de la biopelícula de
P. aeuruginosa aceleró el proceso de remoción, consiguiendo
que alrededor del 90% de la cantidad inicial fuese adsorbida
en la EPS y fibras durante la primera hora de tratamiento.
La mayor tasa de remoción de Plomo en suspensión se ob-
tuvo cuando el cociente que resulta de dividir la cantidad de
fibra (expresada en gramos) entre el volumen del contenedor
(expresado en mL) es aproximadamente igual a 0,15.
El empleo de fibras naturales (P. andina) en conjunto con
biopelículas de P. aeuroginosa resultan una alternativa efi-
ciente, simple y económica para la biorremoción de plomo
en suspensión.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a
la Universidad Nacional de Chimborazo
y la Secretariado de Educación Superior,
Ciencia, Tecnología e Innovación (SENES-
CYT) de la República del Ecuador, por el
financiamiento recibido a través del pro-
grama Prometeo.
R
eferencias
1. Martín, A. 1994. Biodegradation and Bioremediation. Bioremediation Technologies. Academic
Pres. New York
2. Nriagu, J. O, Pacyna, J. M. Quantitative assessment of worldwide contamination of air, water and
soils by trace metals. Nature. 1988; 333(6169), 134-139.
3. Araújo, C. S, Carvalho, D. C, Rezende, H. C, Almeida, I. L, Coelho, L. M, Coelho, N. M., ... Alves,
V. N. Bioremediation of waters contaminated with heavy metals using Moringa oleifera seeds as bio-
sorbent. Applied bioremediation—active and passive approaches. InTech, Crucial. 2013; 225-253.
4. Wiessner, A, Remmler, M, Kuschk, P, Stottmeister, U. The treatment of a deposited lignite pyroly-
sis wastewater by adsorption using activated carbon and activated coke. Colloids and surfaces A:
Physicochemical and engineering aspects. 2009; 139(1), 91-97.
5. Järup, L. Hazards of heavy metal contamination. British medical bulletin. 2003; 68(1), 167-182.
6. U.S. Environmental Protection Agency. www.epa.gov
7. Keleş, E, Özer, A. K, Yörük, S. Removal of Pb 2+ from aqueous solutions by rock phosphate
(low-grade). Desalination. 2010; 253(1), 124-128.
8. Elouear, Z, Bouzid, J, Boujelben, N, Feki, M, Jamoussi, F, Montiel, A. Heavy metal removal from
aqueous solutions by activated phosphate rock. Journal of Hazardous Materials. 2008; 156(1), 412-420.
9. Reichenauer, T. G, Germida, J. J. Phytoremediation of organic contaminants in soil and ground-
water. ChemSusChem. 2008; 1(8‐9), 708-717.
ISSN 1390-5740 Número 17 Vol. 1 (2017)
ISSN 2477-9105

89
Ríos, García, García, García
10. Demirbas, A. Heavy metal adsorption onto agro-based waste materials: a review. Journal of
hazardous materials. 2008; 157(2), 220-229.
11. Volesky, B. Detoxification of metal-bearing effluents: biosorption for the next century. Hydro-
metallurgy. 2001; 59(2), 203-216.
12. Senthil Kumar, P. Adsorption of lead (II) ions from simulated wastewater using natural waste:
a kinetic, thermodynamic and equilibrium study. Environmental Progress & Sustainable Energy.
2014; 33(1), 55-64.
13. Malik, A. Metal bioremediation through growing cells. Environment international. 2004; 30(2),
261-278.
14. Kapoor, A, Viraraghavan, T, Cullimore, D. R. Removal of heavy metals using the fungus Asper-
gillus niger. Bioresource technology. 1999; 70(1), 95-104.
15. Wingender, J, Neu, T. R, Flemming, H. C. What are bacterial extracellular polymeric substan-
ces? In Microbial extracellular polymeric substances. 1999; 1-19. Springer Berlin Heidelberg.
16. Chan, Y.J., Chong, M.F., Law, C.L. & Hassell, D.G. A review on anaerobic–aerobic treatment of
industrial and municipal wastewater. Chemical Engineering Journal. 2009; 155, 1-
17. Mayacela, C, Rivera, M, Tavolaro, A, Molinari, A, Fallico, C. Use of Vegetable Fibers for PRB to
Remove Heavy Metals from Contaminated Aquifers—Comparisons among Cabuya Fibers, Broom
Fibers and ZVI. International Journal of Environmental Research and Public Health. 2017. 14(7), 684.
18. Arroyave, P., & Velásquez, D. Aprovechamiento integral de Furcraea macrophylla Backer. Uni-
versidad EAFIT, 2001. 250.
19. Delvasto, S. An appropiate vacuum technology for manufacture of corrugated fique fiber rein-
forced cementitious sheets. Construction and Building Material. 2010; 187-192.
20. Teitzel, G. M, Parsek, M. R. Heavy metal resistance of biofilm and planktonic Pseudomonas
aeruginosa. Applied and environmental microbiology. 2003. 69(4), 2313-2320.
21. Pardo, R, Herguedas, M, Barrado, E, Vega, M. Biosorption of cadmium, copper, lead and zinc by
inactive biomass of Pseudomonas putida. Analytical and bioanalytical chemistry. 2003. 376(1), 26-32.
22. Ceylan, Ö, Uğur, A. Bio-monitoring of heavy metal resistance in Pseudomonas and Pseudomo-
nas related genus. J. Biol. Environ. Sc. 2012; 6(18), 233-242.
23. Gallardo-Rodríguez, J. J, Ríos-Rivera, A, Felipe-Hernández, D. Evaluation of Furcraea Andina Fi-
bers as Bacterial Support for Biological Denitrification. Journal of Natural Fibers. 2016. 13(6), 691-701.
24. Chakravarty, S, Mohanty, A, Sudha, T. N, Upadhyay, A. K, Konar, J, Sircar, J. K, ... Gupta, K. K.
Removal of Pb (II) ions from aqueous solution by adsorption using bael leaves (Aegle marmelos).
Journal of hazardous materials. 2010; 173(1), 502-509.
25. García, G, Colín, A. Biosorption of lead by maize (Zea mays) stalk sponge. Journal of environ-
mental management. 2010; 91(11), 2079-2086.
26. Garnham, G. W, Codd, G. A, Gadd, G. M. Kinetics of uptake and intracellular location of co-
balt, manganese and zinc in the estuarine green alga Chlorella salina. Applied Microbiology and
Biotechnology. 1992; 37(2), 270-276.
27. Chang, J. S, Law, R, Chang, C. C. Biosorption of lead, copper and cadmium by biomass of Pseu-
domonas aeruginosa PU21. Water research. 1997; 31(7), 1651-1658.