
30
Número 19 Vol. 1 (2018)
EVALUACIÓN DE LA ACTIVIDAD ANTIINFLAMATORIA Y
CITOTÓXICA DE ATRANORINA Y DILACTONA DEL ÁCIDO
PULVÍNICO: COMPUESTOS FENÓLICOS BIOACTIVOS DEL
Evaluation of the Anti-Inammatory and Cytotoxic Activity
of Atranorine and Dilactone of Pulvine Acid: Bioactive Phenolic
R
esumen
A
bstract
Parmelina tiliacea es una especie de liquen de Ecuador que ha sido poco estudiada en relación a sus poten-
ciales aplicaciones. La investigación se llevó a cabo con el objetivo de establecer la actividad antiinamatoria
y citotóxica de P. tiliacea, mediante un método celular in vitro basado en el uso de una sal de tetrazolio solu-
ble (WST-1) sobre neutrólos aislados. Las moléculas de atranorina y dilactona del ácido pulvínico fueron
aisladas del liquen P. tiliacea mediante métodos cromatográcos (cromatografía ash en columna y TLC).
Los compuestos fueron identicados con la ayuda de estudios espectroscópicos (UV e IR), cromatográcos
(TLC) y pruebas de identicación especícas para compuestos liquénicos usando reactivos químicos esta-
blecidos para este tipo de moléculas. Los resultados de actividad citotóxica mostraron una reducción de la
viabilidad celular hasta un 15 – 20% a una concentración de 200 μg/mL de ambos compuestos identicados.
A la misma concentración de 200 μg/mL, la actividad antiinamatoria de atranorina, dilactona del ácido
pulvínico y ácido acetilsalicílico (control positivo) fueron 75.92±0.73%, 73.65±0.44% y 83.77±0.47%, res-
pectivamente. Este estudio constituye la base para investigaciones posteriores sobre líquenes en el Ecuador.
Parmelina tiliacea is an Ecuadorian lichen that has been little studied in relation to its potential applications.
The research was carried out with the objective of establishing the anti-inammatory and cytotoxic activity
of P. tiliacea, by an in vitro cell method based on the use of a soluble tetrazolium salt (WST-1) on isolated
neutrophils. Atranorin and pulvinic dilactone were isolated from lichen P. tiliacea by chromatographic me-
thods (ash column chromatography and TLC). The compounds were identied with the help of spectrosco-
pic studies (UV and IR), chromatographic (TLC) and specic identication tests for lichen compounds using
chemical reagents established for this type of molecules. The results of cytotoxic activity showed a reduction
of cell viability up to 15-20% in the presence of a concentration of 200 μg/mL of these compounds. At the
same concentration of 200 μg / mL, the anti-inammatory activity of atranorin, dilactone of pulvinic acid
and acetylsalicylic acid (positive control) were respectively 75.92±0.73%, 73.65±0.44% and 83.77±0.47%,
respectively. This study represents the basis for subsequent lichen research in Ecuador.
Palabras claves: Parmelina tiliacea, liquen, actividad antiinamatoria, citotoxicidad, WST-1.
Keywords: Parmelina tiliacea, liquen, actividad antiinamatoria, citotoxicidad, WST-1.
Fecha de recepción: 01-dic-2017
Fecha de aceptación: 17-may-2018
ISSN 2477-9105
1
Laboratorio de Productos Naturales, Facultad de Ciencias, Escuela Superior P
olitécnica de Chimborazo, Panamericana Sur km 1 ½, Riobamba-Ecuador.
LÍQUEN PARMELINA TILIACEA
Compounds from The Lichen Parmelina tiliacea
2
Departamento de Farmacología, Facultad de Farmacia, Universitat de València,
46100, Burjassot, Valencia-España
*bfdiegov@hotmail.es
1
Vinueza Diego*,
2
Janeta Marco,
1
Pilco Gisela,
1
Acosta Karen,
1
Abdo Susana

31
Vinueza, Janeta, Pilco, Acosta, Abdo
INTRODUCCIÓN
Los líquenes son una asociación simbió-
tica entre un micobionte heterotróco
(hongo) y un fotobionte autótrofo (pare-
ja fotosintética, un alga verde eucarió-
tica o una cianobacteria). Los líquenes
en estado seco se caracterizan por una
inactivación total de la actividad foto-
sintética y el intercambio de gases. Al
igual que otros organismos poiquilohí-
dricos, la regulación negativa de su me-
tabolismo en estado seco permite que
los líquenes mantengan la integridad
funcional de sus membranas mediante
la inmovilización del citoplasma en una
matriz vítrea multicomponente estable.
La adición de agua a los líquenes secos
puede restaurar su actividad fotosintéti-
ca en pocos minutos. Muchos estudios
han demostrado que las especies de lí-
quenes son notablemente resistentes a
las condiciones ambientales extremas,
haciendo uso de estrategias de adapta-
ción especícas para hacer frente a las
duras condiciones ecológicas. Parme-
lina tiliacea (Hoffm.) Ach. (P. tiliacea)
es una asociación simbiótica entre Par-
melina (un género de hongos liqueniza-
dos) y el alga Trebouxia jamesii (la pa-
reja fotosintética) (1). Los compuestos
aislados de líquenes han sido amplia-
mente estudiados en detalle alrededor
de todo el mundo, particularmente en
su composición química. Sin embargo,
en Ecuador los estudios han sido limi-
tados. La primera investigación en el
Ecuador continental está enfocada prin-
cipalmente en la distribución geográca
de líquenes (2). El primer informe de
aislamiento de atranorina reportado fue
en Stereocaulon vesuvianum (3). Ac-
tualmente, un protocolo común de ais-
lamiento de atranorina está relacionado
con una investigación de Cladina kalbi
(4). Se han estudiado varias actividades
biológicas in vitro de atranorina aisla-
da de C. kalbii, tales como su efecto
antioxidante y citoprotector en líneas
celulares SH-SY5Y (5). La atranorina
aislada de Parmotrema saccatilobum fue ensayada para
la inhibición de ciclooxigenasa in vitro (6).
Por otra parte, el compuesto dilactona del ácido pulvínico
ha sido escasamente estudiado en relación a su potencial
aplicación biológica. Los trabajos sobre este compues-
to se han centrado en sus cambios estructurales (7) y su
caracterización química mediante espectroscopía FT-Ra-
man (8).
A través de esta investigación, se logró determinar la ac-
tividad antiinamatoria y citotoxicidad in vitro de dos
compuestos aislados del liquen ecuatoriano P. tiliacea
mediante un ensayo simple utilizando la sal de tetrazolio
soluble en agua (WST-1) sobre el modelo celular de neu-
trólos aislados.
MATERIALES Y MÉTODOS
Material liquénico y reactivos químicos
La muestra de P. tiliacea fue recolectada en Ecuador,
provincia de Bolívar, cantón San Miguel, recinto Lagua-
tan, sector S 01° 43’ 51.139’’ W 079° 3’ 4.402’’, a una
altitud promedio de 2714 m.s.n.m. Los reactivos Fico-
ll paque, solución modicada de Hanks, Zimosan A y
Triton X-100, fueron adquiridos a Sigma-Aldrich, S.L.
(USA). La sal de tetrazolio soluble (WST-1) fue adqui-
rida a Roche (USA), el ácido acetilsalicílico a J.T. Baker
(USA), el dimetilsulfóxido y cloruro de amonio a Merck
(Germany). Cabe remarcar que se usó agua desionizada
en todos los procedimientos experimentales.
Aislamiento e identicación de atranorina
y dilactona del ácido pulvínico
El aislamiento de los compuestos atranorina y dilactona
del ácido pulvínico a partir de P. tiliacea (25 g) fue lleva-
do a cabo mediante extracción por reujo usando etanol
(500 mL). Después de someter el extracto a concentra-
ción en rotavapor bajo condiciones controladas (45°C
and -0.5 bar) se obtuvieron 4.6967 g de residuo sólido.
Posteriormente, se llevó a cabo la cromatografía del re-
siduo sólido redisuelto usando un sistema de solventes
que consistió en una mezcla de tolueno, acetato de etilo
y ácido fórmico (139:83:8). Las fracciones eluídas que
contenían el mismo compuesto (comprobado mediante
TLC) fueron reunidas. Después de la evaporación del
solvente el rendimiento de los compuestos obtenidos fue
respectivamente: C1 (23.7 mg) and C2 (21.2 mg).
Los espectros IR fueron registrados en un espectrofotó-
metro Jasco FT/IR-4100. Los espectros UV fueron re-
32
Número 19 Vol. 1 (2018)
gistrados en un espectrofotómetro Thermo Spectronic
HeλOS-β. La cromatografía se llevó a cabo sobre placas
de silica gel 60 F254 (20x20 cm, 0.25 mm, Merck) y los
compuestos fueron detectados bajo luz UV (254 y 366
nm), mientras que una solución de ácido sulfúrico al 10%
en etanol se usó como reactivo revelador. La placa fue
sometida a calentamiento para el desarrollo de las man-
chas (9-10).
Ensayos de actividad biológica
Se realizó la extracción de muestras frescas de sangre
venosa en voluntarios sanos, a partir de las cuales fue-
ron aislados los neutrólos (11). La sangre fue añadida
al reactivo Ficoll paque, la mezcla obte-
nida fue centrifugada durante 30 minu-
tos a 1500 rpm. Después de descartar el
sobrenadante, las trazas de células rojas
sanguíneas fueron lisadas mezclando el
pellet con una solución hipotónica de
cloruro de amonio (0.83%). La suspen-
sión fue centrifugada nuevamente y los
neutrólos fueron lavados con solución
modicada de Hanks (pH 7.4) y resus-
pendidas a la concentración de 107 cé-
lulas/mL en un volumen apropiado de
solución modicada de Hanks (12). Las
células metabólicamente activas redu-
cen las sales de tetrazolio para producir
compuestos coloreados derivados de
formazán; de manera que los ensayos
colorimétricos basados en sales de te-
trazolio detectarán únicamente células
viables. Estos ensayos sensibles pue-
den ser fácilmente llevados a cabo en
un lector de microplacas con un núme-
ro relativamente bajo de células usando
un método modicado (13). En este es-
tudio, los neutrólos humanos aislados
(107 células/mL) fueron incubados con
los compuestos de prueba durante 30
minutos; posteriormente, la sal de te-
trazolio WST-1 (250 μM) fue añadida y
la mezcla fue incubada a 37°C por 3 h.
La absorbancia se registró a una longi-
tud de onda de 450 nm. El tensoactivo
Triton X-100 (0.1%) fue usado como
control negativo exhibiendo 0.00% de
viabilidad celular (12). Una solución
de DMSO 5% fue usada como blanco
mostrando 100.00% de viabilidad celu-
lar. Los valores obtenidos son el pro-
medio de cinco repeticiones. El porcen-
taje de viabilidad celular fue calculado
mediante la siguiente fórmula y los re-
sultados se muestran en la Tabla 1:
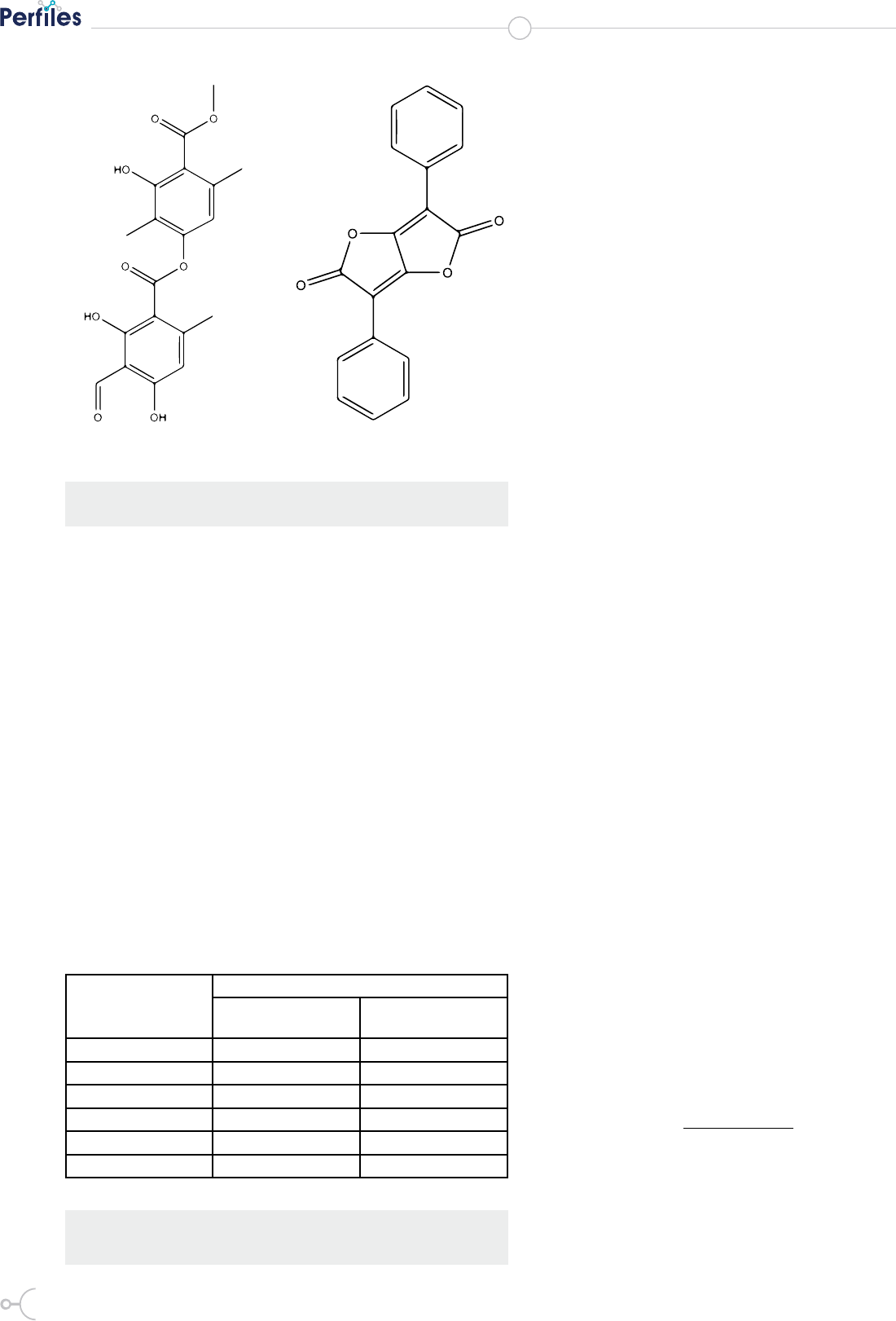
Figura 1. Estructuras de a) Atranorina y b) Dilactona del ácido pulvínico
a) b)
CONCENTRACIÓN
(μg/mL)
VIABILIDAD CELULAR (%)
Atranorina
Dilactona del ácido
pulvínico
200 14.98±0.75 20.47±0.46
100 24.19±0.29 25.39±0.42
50 42.27±0.30 38.86±0.93
25 71.04±0.33 58.81±1.24
12.5 83.44±0.63 90.67±3.45
LC
50
55.64±1.22 53.19±4.46
Los resultados son el promedio±SD de al menos 5 repeticiones
Tabla 1. Porcentaje de viabilidad celular de los compuestos a diferentes
concentraciones.
% Viabilidad celular =
od
compuestos
od
dmso
x 100
La actividad antiinamatoria fue deter-
minada usando un método modicado
(14). Este ensayo in vitro está basado
ISSN 2477-9105
33
Vinueza, Janeta, Pilco, Acosta, Abdo
en la reducción de la sal WST-1 en la
presencia de neutrólos activados. El
ensayo antiinamatorio fue determina-
do en un volumen total de 250 μL de
solución modicada de Hanks (pH 7.4)
conteniendo 104 neutrólos/μL, 500
μM WST-1 y las concentraciones de
los compuestos de prueba o referencia.
El blanco estuvo constituido por buffer,
neutrólos y WST-1. Todos los com-
puestos fueron equilibrados a 37°C y la
reacción fue iniciada mediante la adi-
ción de Zymosan A opsonizado (15 mg/
mL), el cual fue preparado mezclando
Zymosan A con suero humano, seguido
de centrifugación a 3000 rpm y el pa-
llet fue resuspendido en solución buffer
de fosfato. La absorbancia se registró a
una longitud de onda de 450 nm (12).
Ácido acetilsalicílico fue usado como
control positivo, dado que es un anti-
inamatorio no esteroidal ampliamente
utilizado para el tratamiento de enfer-
medades inamatorias (15-16). Los va-
lores de IC
50
fueron calculados mediante
comparación con la solución de DMSO
usada como blanco y expresados como
porcentaje de inhibición de aniones su-
peróxido producidos.
Análisis de datos
Todos los resultados son expresados
como el promedio ± desviación estándar
(SD). Un valor de P<0.05 fue considera-
do para indicar diferencia signicativa.
La LC
50
para el ensayo de citotoxicidad
y IC
50
para el ensayo antiinamatorio
fueron determinados mediante análisis
probit. El test de Student y la prueba de
ANOVA-Tukey se usaron para compa-
rar diferencias signicativas entre los
resultados según fue aplicable.
RESULTADOS
Fueron aislados atranorina y la dilacto-
na del ácido pulvínico a partir del liquen
P. tiliacea, usando técnicas cromatográ-
cas sencillas. Los compuestos fueron
caracterizados mediante espectroscopía UV (Atranorina
λmáx nm: 210, 249, 320; dilactona del ácido pulvínico
λmáx nm: 241, 275, 369), espectroscopía IR (atranori-
na νmáx cm-1: 3040, 1803, 1667, 1451, 1270; dilactona
del ácido pulvínico νmáx cm-1: 2945, 2835, 1630, 1599,
1264), pruebas químicas simples (atranorina y dilactona
del ácido pulvínico no fueron reactivas con las pruebas
químicas estandarizadas para identicación de com-
puestos liquénicos) así como cromatografía en capa na
(sistemas de solventes A (tolueno, dioxano, ácido acé-
tico 180:45:5), B (hexano, éter dietílico, ácido fórmico
130:80:20), C (tolueno, ácido acético 170:30), G (tolue-
no, etil acetato, ácido fórmico 139:83:8) (atranorina: RfA
75.6, RfB 77.0, RfC 79.0, RfG X y dilactona del ácido
pulvínico: RfA 80.3, RfB 83, RfC 89.7, RfG X) (9). En
la Fig.2 se muestran las estructuras de los compuestos
aislados.
Como se muestra en la Tabla 1, el porcentaje de viabi-
lidad celular disminuye al incrementarse las concentra-
ciones de atranorina y dilactona del ácido pulvínico. No
existen diferencias signicativas entre las concentracio-
nes evaluadas de atranorina y dilactona del ácido pulví-
ninco (p<0.05 Student t-test). La Tabla 2 indica los por-
centajes de actividad antiinamatoria de los compuestos
aislados (atranorina y dilactona del ácido pulvíninco). Se
demuestra una relación directamente proporcional entre
CONCENTRACIÓN
(μg/mL)
ACTIVIDAD ANTIINFLAMATORIA (%)
Atranorina
Dilactona del ácido
pulvínico
200 75.92±0.73 73.65±0.44
100 63.77±0.54 54.88±1.08
50 46.15±0.63 37.52±0.91
25 27.22±1.04 21.86±0.29
Los resultados son el promedio±SD de al menos 5 repeticiones
Tabla 2. Porcentaje antiinflamatorio de los compuestos a diferentes
concentraciones.
COMPUESTO INHIBICIÓN A
200 μg/mL (%)
IC50±SDa (μg/
mL)
Atranorina 75.92±0.73 61.21±4.00
Dilactona del ácido pulvínico 73.65±0.44 80.26±4.93
Ácido acetilsalicílico 83.77±0.47* 2.49±0.19
a SD fue la desviación estándar de 5 ensayos, *Valores signicativos,
P<0.05, usando el test de Tukey.
Tabla 3. Valores de IC50 (μg/mL) de los compuestos y el control
positivo a 200 μg/mL

34
Número 19 Vol. 1 (2018)
la actividad antiinamatoria y concentración de las sus-
tancias de prueba; sin embargo, no se observaron dife-
rencias signicativas entre las concentraciones ensaya-
das (p<0.05 Student t-test). En la Tabla 3, se muestra la
actividad antiinamatoria expresada como IC50 (μg/mL)
de los compuestos obtenidos (atranorina y dilactona del
ácido pulvíninco), como del control positivo a una con-
centración de 200 μg/mL. Finalmente, existe la posibi-
lidad de que las diferencias entre los valores promedio
de actividad antiinamatoria entre los compuestos ob-
tenidos y la referencia (control positivo); muestren una
diferencia signicativa a la concentración de 200 mg/kg
(p <0,001 Tukey test).
DISCUSIÓN
Los resultados obtenidos fortalecen las hipótesis plan-
teadas en investigaciones precedentes sobre el potencial
efecto antiinamatorio asociado a la molécula atranorina,
dado que según aquellas el efecto positivo de la atrano-
rina sobre la respuesta inamatoria podría estar relacio-
nado con la inhibición inducida por la atranorina sobre la
actividad de la ciclooxigenasa (COX-1 y COX-2) (6) y el
bloqueo de la biosíntesis del leucotrieno B4 (17), lo que
podría conducir a un efecto antiinamatorio (18). Adicio-
nalmente, en un estudio recopilatorio sobre el efecto de
varias moléculas para combatir el dolor, se establece que
aquel efecto en el caso de la atranorina podría deberse a la
inhibición de la liberación de sustancia P o a una acción
de bloqueo directo sobre su receptor de neuroquinina 1
(NK-1) (19). Asimismo, se sugiere un posible efecto an-
tinociceptivo de la atranorina para actuar periféricamente
sobre los mediadores inamatorios, especialmente pros-
taglandinas (4). Los mecanismos precisos a través de los
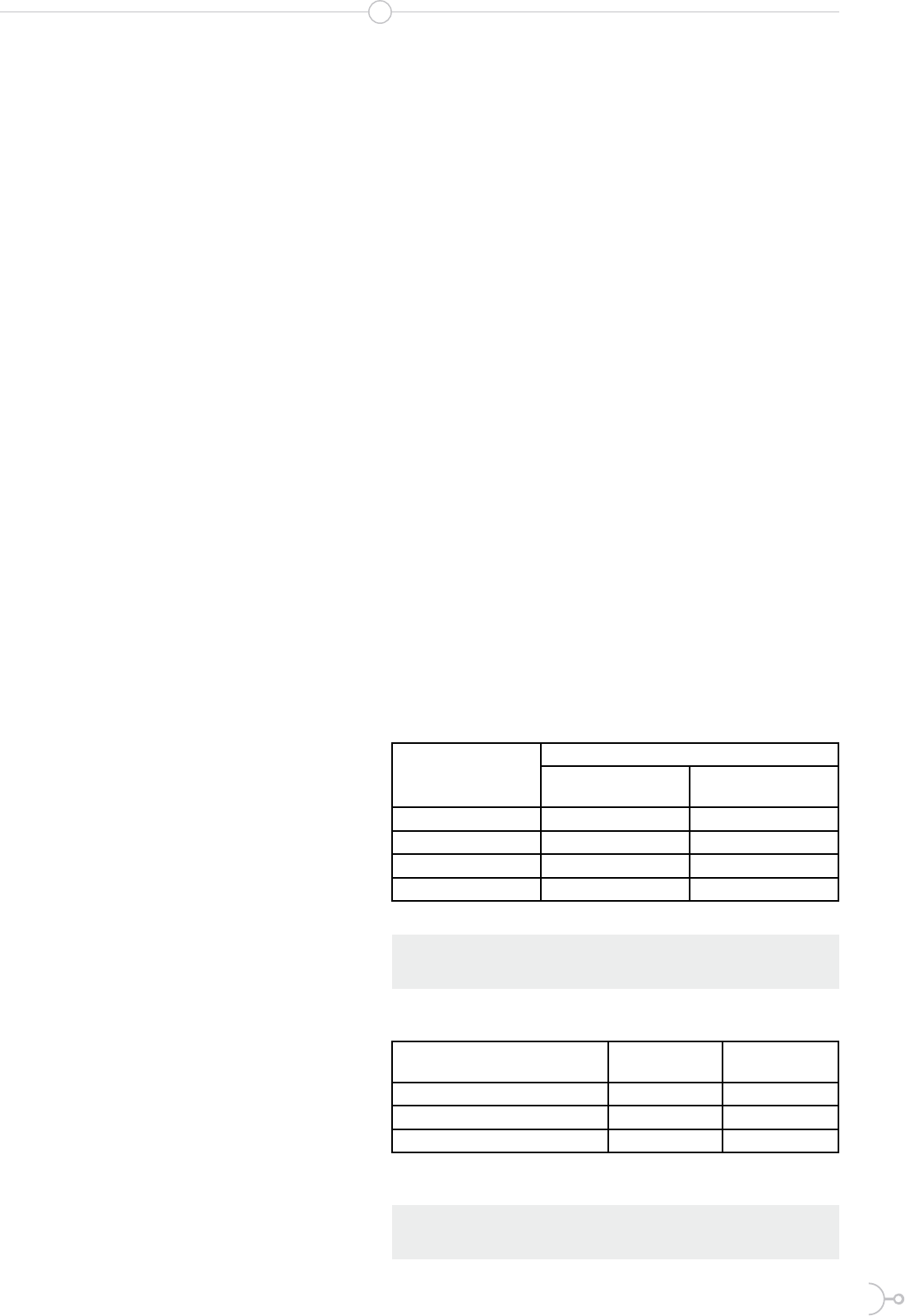
90
80
70
60
50
40
30
20
10
0
Inhibición inamatoria %
0 50 100 150 200 250
Concentración, µg/mL
Atranorina
Dilactona del
ácido púlvico
Acido
acetilsalicílico
Figura 2. Comportamiento antiinflamatorio de los compuestos
aislados y referencia.
cuales la atranorina ejerce su acción es-
tán actualmente bajo investigación, pero
posiblemente podrían estar relacionados
con la cascada de ácido araquidónico
y/o la modulación de la producción de
moléculas proinamatorias (20-21).
Numerosos líquenes contienen pigmen-
tos amarillos o anaranjados que se com-
ponen de dos unidades de fenilpropano,
en las que la unidad C3 de estos ácidos
derivados de líquenes es isopropilo en
lugar de propilo (22). Los derivados de
ácido vulpínico, un éster metílico del
prototipo de ácido pulvínico, fueron de
las primeras moléculas liquénicas en ser
evaluadas como agentes antiinamato-
rios mediante la prueba de artritis adyu-
vante en ratas (23). En cuanto a la dilac-
tona del ácido pulvínico la información
disponible determina su importancia
como una sustancia responsable de efec-
tos fotoprotector y cardiotónico (24). El
efecto antiinamatorio de la dilactona
del ácido pulvínico se suma a las activi-
dades demostradas para esta sustancia,
sin embargo; son necesarios mayores es-
fuerzos para determinar los mecanismos
mediante los cuales ejerce su acción en
términos moleculares. Finalmente, la
citotoxicidad de las sustancias aisladas
no presentó diferencias estadísticamen-
te signicativas, lo cual constituye una
medida relativa de la seguridad del uso
potencial de estas moléculas para com-
batir trastornos inamatorios.
CONCLUSIONES
Los compuestos atranorina y dilactona
del ácido pulvínico fueron satisfacto-
riamente aislados del liquen P. tiliacea
mediante extracción con reujo y téc-
nicas cromatográcas. Los compuestos
fueron identicados mediante espectros-
copía UV, IR, cromatogracas (TLC) y
pruebas químicas de identicación para
compuestos liquénicos, puesto que los
máximos de absorción (nm) del espec-
tro UV y las bandas de absorción en IR
(cm-1) corresponden a investigaciones
ISSN 2477-9105

35
Vinueza, Janeta, Pilco, Acosta, Abdo
preliminares de estas moléculas (8-9)
(25-26). Los resultados indican que los
compuestos liquénicos aislados de P.
tiliacea muestran una apreciable activi-
dad antiinamatoria bajo el modelo ex-
perimental. Sin embargo, no alcanzan el
mismo nivel de actividad antiinamato-
ria que el compuesto de referencia (áci-
do acetilsalicílico) como se muestra en
la Fig.2. A pesar de lo anterior, el poten-
cial de estos compuestos para utilizarlos
en el futuro como candidatos a fárma-
cos antinamatorios resulta evidente.
Además, aunque según el “Catalogue
of standardized chromatographic data
and biosynthetic relationships for lichen
substances” publicado por John A. Elix
(9), la identidad de un compuesto liquénico desconocido
puede ser conrmada solamente mediante TLC compara-
tiva en al menos tres sistemas de solvente. Se recomienda
para posteriores investigaciones realizar estudios de los
compuestos aislados mediante HPLC/MS para tener un
100% de conrmación estructural.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la Escuela Su-
perior Politécnica de Chimborazo por brindar las instala-
ciones para llevar a cabo esta investigación.
CONFLICTO DE INTERESES
Los autores declaran no tener conictos de interés.
R
eferencias
1. Oukarroum A, El Gharous M, Strasser RJ. Does Parmelina tiliacea lichen photosystem II survive at
liquid nitrogen temperatures? Cryobiology [Internet]. 2017 [citado el 22 Enero 2018]; 74: 160–2. Dispo-
nible en: http://dx.doi.org/10.1016/j.cryobiol.2016.12.005.
2. Cevallos-Solórzano G. Checklist de líquenes y hongos liquenícolas de Ecuador continental. 2012. Con-
servación de la Diversidad Biológica. Universidad Rey Juan Carlos; 37 p.
3. Bolognese A, Chioccara F, Scherillo G. Phytochemical reports. Phytochemistry. 1974; 13: 1989–90.
4. Melo MGD, Araújo AAS, Rocha CPL, Almeida EMSA, Siqueira RDS, Bonjardim LR, et al. Purica-
tion, physicochemical properties, thermal analysis and antinociceptive effect of atranorin extracted from
Cladina kalbii. Biol Pharm Bull. 2008; 31(10): 1977–80.
5. Melo MGD, dos Santos JPA, Serani MR, Caregnato FF, de Bittencourt Pasquali MA, Rabelo TK, et
al. Redox properties and cytoprotective actions of atranorin, a lichen secondary metabolite. Toxicol Vitr.
2011; 25(2): 462–8.
6. Bugni TS, Andjelic CD, Pole AR, Rai P, Ireland CM, Barrows LR. Biologically active components of a
Papua New Guinea analgesic and anti-inammatory lichen preparation. Fitoterapia. 2009; 80(5): 270–3.
7. Ijima H, Ebizuka Y, Sankawa U, Yamamoto E, Towers GHN. An inducible lactone hydrolase yielding
2,5-diphenyl-3-hydroxy-4-oxo-2hexendioic acid from pulvinic acid. Phytochemistry. 1983; 22(2): 371–4.
8. Fernandes RF, Ferreira GR, Spielmann AA, Edwards HGM, De Oliveira LFC. FT-Raman spectroscopy
of the Candelaria and Pyxine lichen species: A new molecular structural study. J Mol Struct [Internet]. 2015
[citado el 22 Enero 2018]; 1102: 57–62. Disponible en: http://dx.doi.org/10.1016/j.molstruc.2015.08.040
9. Elix JA. A catalogue of standardized chromatographic data and biosynthetic relationships for lichen
substances. Third Edition. Published by the author, Canberra (Australia). 2014. 323 p.
10. Huneck S, Yoshimura I. Identication of Lichen Substances. Springer-Verlag Berlin Heidelberg;
1996. 493 p.
11. Siddiqui RA, English D, Harvey K, Cui Y, Martin MI, Wentland J, et al. Phorbol ester-induced priming
of superoxide generation by phosphatidic acid-stimulated neutrophils and granule-free neutrophil cyto-
plasts. J Leukoc Biol. 1995; 58(2): 189–95.
12. Choudhary MI, Jalil AS, Rahman A. Bioactive phenolic compounds from a medicinal lichen , Usnea
longissima. Phytochemistry. 2005; 66: 2346–50.

36
Número 19 Vol. 1 (2018)
13. Berridge M V, Tan ANS, Mccoy KD, Wang RUI. The Biochemical and Cellular Basis of Cell Prolife-
ration Assays That Use Tetrazolium Salts. Biochemica. 1996; (4): 14–9.
14. Tan AS, Berridge M V. Superoxide produced by activated neutrophils efciently reduces the tetrazo-
lium salt , WST-1 to produce a soluble formazan : a simple colorimetric assay for measuring respiratory
burst activation and for screening anti-inammatory agents. J Immunol Methods. 2000; 238: 59–68.
15. Macdonald TM, Beard K, Bruppacher R, Hasford J, Lewis M, Logan RF, et al. The safety of drugs for
OTC use : what evidence is required for an NSAID switch ? Pharmacoepidemiol Drug Saf. 2002; (11):
577–84.
16. Martin C, Connelly A, Keku TO, Mountcastle SB, Galanko J, Woosley JT, et al. Nonsteroidal Anti-in-
ammatory Drugs, Apoptosis, and Colorectal Adenomas. Gastroenterology. 2002; (123): 1770–7.
17. Kumar KC S, Müller K. Lichen metabolites. 2. Antiproliferative and cytotoxic activity of gyrophoric,
usnic, and diffractaic acid on human keratinocyte growth. J Nat Prod. 1999; 62(6): 821–3.
18. Barreto RSS, Albuquerque-Júnior RLC, Pereira-Filho RN, Quintans JSS, Barreto AS, DeSantana JM,
et al. Evaluation of wound healing activity of atranorin, a lichen secondary metabolite, on rodents. Brazi-
lian J Pharmacogn [Internet]. 2013 [citado el 22 Enero 2018]; 23(2): 310–9. Disponible en: http://dx.doi.
org/10.1590/S0102-695X2013005000010
19. Holanda Pinto SA, Pinto LMS, Guedes MA, Cunha GMA, Chaves MH, Santos FA, et al. Antinocep-
tive effect of triterpenoid α,β-amyrin in rats on orofacial pain induced by formalin and capsaicin. Phyto-
medicine. 2008; 15(8): 630–4.
20. Siqueira RS, Bonjardim LR, Araújo AAS, Araújo BES, Melo MGD, Oliveira MGB, et al. Antino-
ciceptive activity of atranorin in mice orofacial nociception tests. Zeitschrift fur Naturforsch - Sect C J
Biosci. 2010; 65 C(9–10): 551–61.
21. Siqueira-Lima PS, Silva JC, Quintans JSS, Antoniolli AR, Shanmugam S, Barreto RSS, et al. Na-
tural products assessed in animal models for orofacial pain – a systematic review. Rev Bras Farmacogn
[Internet]. 2017 [citado el 22 Enero 2018]; 27(1): 124–34. Disponible en: http://linkinghub.elsevier.com/
retrieve/pii/S0102695X16301879
22. Müller K. Pharmaceutically relevant metabolites from lichens. Appl Microbiol Biotechnol. 2001;
56(1–2): 9–16.
23. Foden FR, McCormick J, O’Mant DM. Vulpinic Acids as Potential Antiinammatory Agents. 1. Vul-
pinic Acids with Substituents in the Aromatic Rings. J Med Chem. 1975; 18(2): 199–203.
24. Atta-ur-Rahman. Studies in Natural Products Chemistry. First edit. Elsevier B.V.; 2013. 476 p.
25. Manojlović N, Ranković B, Kosanić M, Vasiljević P, Stanojković T. Chemical composition of three
Parmelia lichens and antioxidant, antimicrobial and cytotoxic activities of some their major metabolites.
Phytomedicine. 2012; 19(13): 1166–72.
26. Edwards HGM, Newton EM, Wynn-Williams DD. Molecular structural studies of lichen substances
II: Atranorin, gyrophoric acid, fumarprotocetraric acid, rhizocarpic acid, calycin, pulvinic dilactone and
usnic acid. J Mol Struct. 2003; 651–53: 27–37.
ISSN 2477-9105