
13
Miranda, Vinueza, Acosta, Toaquiza, Méndez, Arias
ESTUDIO FITOQUÍMICO PRELIMINAR Y EVALUACIÓN DE
LA ACTIVIDAD CITOTÓXICA DEL LÁTEX DE EUPHORBIA
LAURIFOLIA JUSS. EX. LAM SOBRE ARTEMIA SALINA
Preliminary Phytochemical Study and Evaluation of Cytotoxic Activity
of Euphorbia laurifolia Juss. ex. Lam latex on Artemia salina
Aida Miranda*, Diego Vinueza, Karen Acosta, Cecilia Toaquiza,
Estela Mendez, Fabian Arias
Facultad de Ciencias, Escuela Superior Politécnica de Chimborazo, Panamericana
Sur km 1 ½, Riobamba-Ecuador.
aidita_6799@hotmail.es
R
esumen
A
bstract
Euphorbia laurifolia es una especie vegetal de la familia Euphorbiaceae distribuida en Colombia,
Venezuela y Ecuador. Tradicionalmente es usada para el tratamiento de afecciones al hígado, para
evitar la formación de abscesos y verrugas en la piel. Debido a su alta disponibilidad y variedad de
usos constituye una materia prima de importancia toquímica y farmacológica. El objetivo de esta
investigación fue realizar el estudio toquímico preliminar y la evaluación de la actividad citotóxica
del látex de E. laurifolia sobre Artemia salina. Se obtuvieron diversos extractos del látex de la espe-
cie, a partir de los cuales se realizó la separación e identicación mediante Cromatografía en Capa
Fina (TLC). La evaluación de la actividad citotóxica sobre Artemia salina se llevó a cabo utilizando
la fracción hexánica usando concentraciones de 0, 31, 62, 125, 250, 500, 1000 ppm. Se estableció
que E. laurifolia presenta compuestos terpénicos, identicando por TLC posibles moléculas como el
borneol (Rf 0.24) y el cineol (Rf 0.40). Respecto a la citotoxicidad de la fracción hexánica, se obtuvo
una concentración letal media (LC50) de 214.50 ppm, demostrando que el extracto es tóxico. El látex
de E. laurifolia es rico en compuestos terpénicos con alta actividad citotóxica; por tanto, presenta un
destacable potencial para futuros estudios farmacológicos.
Euphorbia laurifolia is a plant species that belongs to the family Euphorbiaceae located in Colombia,
Venezuela and Ecuador. Traditionally, it is used for liver affections and to avoid the formation of skin
abscesses and warts. Due to its high availability and variety of uses, it has phytochemical and phar-
macological importance. The aim of this investigation was to carry out preliminary phytochemical
study and evaluation of the cytotoxic activity of E. laurifolia latex on Artemia salina. Several latex
extracts, separation and identication of compounds was performed by Thin Layer Chromatography
(TLC). The evaluation of the cytotoxic activity on Artemia salina was carried out using the hexanic
fraction at concentrations of 0, 31, 62, 125, 250, 500, 1000 ppm. It was established that E. laurifolia
contains terpene compounds, identied by TLC molecules such as borneol (Rf 0.24) and cineole (Rf
0.40). Regarding the cytotoxicity of the hexane fraction, the lethal concentration (LC50) was 214.50
ppm, showing that the extract is toxic. The latex of E. laurifolia is rich in terpene compounds with
Palabras claves: Euphorbia laurifolia, actividad citotóxica, Artemia salina, látex, terpenos, Euphorbiaceae

14
Revista Cientíca
ISSN 2477-9105
Número 20 Vol. 2 (2018)
high cytotoxic activity; therefore, it presents a remarkable potential for future pharmacological stu-
dies.
Keywords: Euphorbia laurifolia, cytotoxic activity, Artemia salina, latex, terpenes, Euphorbiaceae.
Fecha de recepción: 30-05-2018 Fecha de aceptación: 11-07-2018
I. INTRODUCCIÓN
La familia Euphorbiaceae corresponde al vegetal más
extenso de las angiospermas, muy utilizada en la medi-
cina tradicional e incluye casi 8000 especies (1). Los di-
terpenoides del género Euphorbia presentan actividades
irritantes en la piel y ojos (2) (3), actividad apoptótica (4)
y citotóxica en células (5).
La familia Euphorbiacea se caracteriza por sus hojas gla-
bras, estípulas ausentes y numerosas ores masculinas
rodeando una or femenina central pedicelada y de for-
ma particular segrega un látex lechoso (6). El látex es
utilizado para el tratamiento de afecciones del hígado en
forma de emplastos, formación de abscesos y verrugas
en la piel. (7).
Se ha evaluado la efectiva capacidad molusquicida de
varias especies de Euphorbiaceae, entre ellas la E. pul-
cherrima y E. hirta contra caracoles Lymnaea acumina-
ta (8), E. splendens y E. aphylla contra Biomphalaria
alexandrina (9) y la E. helioscopia con la E. schimperia-
na contra Biomphalaria pfeifferi
La especie Euphorbia laurifolia es un arbusto presente
en la zona andina de Venezuela, Colombia y Ecuador a
1000 y 3000 msnm. En el género Euphorbia se ha iden-
ticado diferentes compuestos terpénicos como anti-
quol C, antiquol B, euphorbol, camelliol C (11). Ávila,
L, et al, (2010) identicaron compuestos triterpénicos
como el lanosterol y la latazienona, además de un nue-
vo compuesto diterpénico macrocíclico tipo latirano.
La actividad viral de la E. laurifolia fue estudiada fren-
te al virus de la inmunodeciencia humana tipo 1 VIH
1 (1) y su actividad molusquicida contra Biomphalaria
glabrata (12) presentando resultados favorables en am-
bos estudios.
Al considerar los estudios previos el objetivo del presen-
te trabajo fue determinar la actividad citotóxica de la es-
pecie Euphorbia laurifolia frente Artemia salina, con el
n de proporcionar una base cientíca para futuros aná-
lisis antimicrobianos.
II. MATERIALES Y MÉTODOS
Material vegetal
Se utilizó el látex de Euphorbia laurifo-
lia, el cual fue recolectado en la parro-
quia Cubijíes, provincia de Chimborazo,
(latitud: -1.65 longitud: -78.5833). La
zona de recolección presenta un clima
generalmente frio, con temperatura que
oscila entre de 12 ºC y 16 ºC y una al-
titud de 2503 m s. n. m. La especie fue
identicada por el Ingeniero Jorge Ca-
ranqui, responsable del herbario de la
Facultad de Ciencias-ESPOCH (Est. Es-
poch: Carolina Huaraca 2899)
Material biológico: Artemia salina
El material biológico fue adquirido en esta-
dío de huevos, los cuales fueron incubados
en condiciones de agua salada a una tem-
peratura entre 25-32 °C hasta su eclosión.
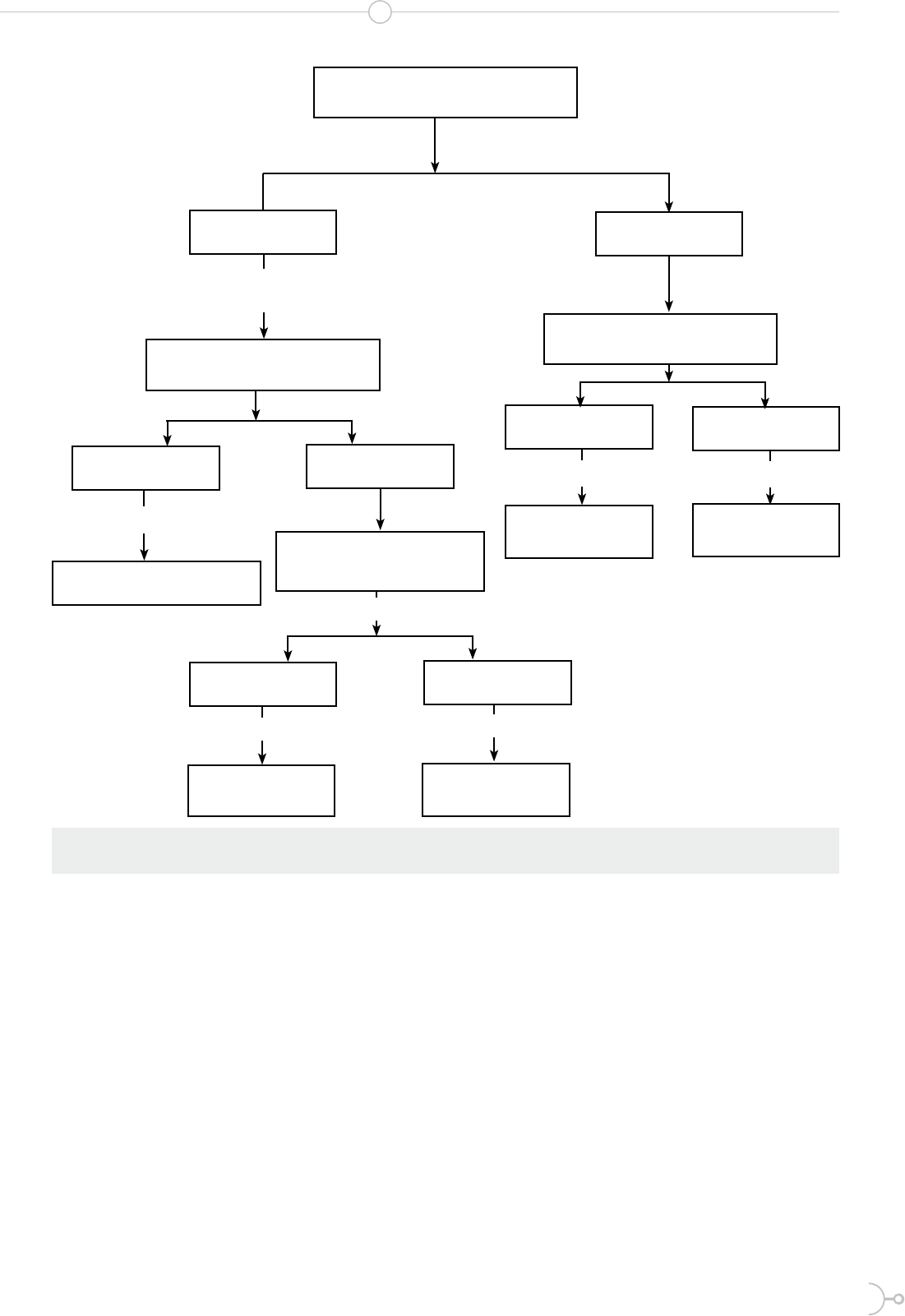
Obtención de extractos
El látex segregado de E. laurifolia fue
obtenido a través de un corte transver-
sal en las axilas iniciales de las ramas,
en dichos cortes se presenta una emana-
ción de secreción la cual fue recolectada
en metanol. La solución alcohólica se
dejó en maceración por 24 horas en un
lugar fresco y seco, en ausencia de luz.
El látex macerado se ltró a través de
una membrana de 11 µm de porosidad.
El ltrado metanólico fue concentrado a
40 °C hasta sequedad; se reconstituyó
con hexano con la nalidad de separar
compuestos apolares de los polares. La
fase hexánica se concentró (Fr 1) y la
15
Miranda, Vinueza, Acosta, Toaquiza, Méndez, Arias
Recolección de látex en metanol
Filtrado
Residuo
Redisolución con hexano
Fase hexánica
Fr. 1. Extracto hexánico
Residuo
Redisolución con
MeOH:H
2
0
Fase etérea
Fase MOH:H
2
O
Fr 2. Extracto
etéreo
Fr 3. Extracto
MeOH:H
2
O
Separación de hexano
Fase hexánica
Residuo
Fr 4. Extracto
hexánico 2
Fr 5. Extracto
acetónico
Evaporación al
vacío a 40 ºC
Añadir acetona
Concentrar
Concentrar
Concentrar
Añadir éter dietílico
Concentrar
Concentrar
Filtrar
Figura 1. Proceso de obtención de los extractos del látex Euphorbia laurifolia
parte insoluble en hexano se reconstitu-
yó con MeOH: H
2
O (1:1), a la cual se
añadió éter para la separación de posi-
bles compuestos apolares restantes. Tan-
to la fase MeOH: H
2
O (Fr 3) como la
etérea (Fr 2) fueron concentradas (13).
La fase sólida ltrada fue disuelta en
acetona, añadiendo un volumen propor-
cional de hexano para la separación de
compuestos apolares. La fase hexánica
(Fr 4) y acetónica (Fr 5) fueron separa-
das y concentradas hasta sequedad. El
proceso de obtención de los extractos se
detalla en la gura 1.
El objetivo de realizar cinco extracciones fue identicar
extractos que contengan mayor cantidad de compuestos
terpénicos
Separación e identicación de compuestos
por cromatografía en capa na (TLC)
Cada uno de los extractos obtenidos anteriormente fueron
sometidos a cromatografía en capa na (TLC) empleando
placas de sílice gel 60F 254 de 10 cm x 4 cm. Se usó como
fase móvil tolueno y acetato de etilo en una relación (7:3)
(2). Se observó bajo la luz UV los componentes terpénicos
y posteriormente se reveló con ácido sulfúrico-vainillina
(50:50) sometiéndolas al calor por dos minutos.

16
Revista Cientíca
ISSN 2477-9105
Número 20 Vol. 2 (2018)
Determinación de LC50 de la fracción hexánica
Eclosión de A. salina
Los huevos de A. salina se incubaron durante 48 h en una
solución NaCl 1% exenta de nitrato, fosfato y silicato a
una temperatura controlada entre 26-30 ºC, en presencia
de una lámpara de tungsteno. Durante el tiempo de incu-
bación, la solución fue oxigenada a través de una bomba
de aire.
Ensayo de letalidad
Para el bioensayo solamente se utilizó el extracto hexáni-
co (Fr 1), debido a que el extracto etéreo dio problemas
en la solubilidad.
Para la preparación de la solución madre del extracto
hexánico se pesaron 0,025 g de extracto, se disolvieron
en 0,25 ml de dimetil sulfoxido (DMSO) y se aforaron a
25 mL con solución de NaCl 0,1 %. Para la obtención
del blanco, se disolvieron 0,25 mL de DMSO en 25 mL
de NaCl 0,1 %.
La fracción hexánica fue preparada a concentraciones
de 0; 31; 62; 125; 250; 500; 1000 ppm del extracto en
NaCl 0,1 %. Cada una de las diluciones fueron coloca-
das en tubos de ensayo donde fueron liberadas 10 larvas,
sumergiéndolas en la solución para evitar el contacto con
el aire (18). Después de 24 h, se determinó el porcen-
taje de letalidad a cada concentración y se interpretó:
0-10 % no tóxico, 11-50 % moderadamente tóxico, 51-90
% altamente tóxico y 100 % extremadamente tóxico (22).
Todos los ensayos se realizaron por triplicado.
Además, los datos obtenidos se tabularon a través del
software estadístico Análisis Probit TSK para la determi-
nación del nivel LC50 (17).
El extracto vegetal se considera tóxico si presenta un va-
lor de LC50 menor de 1000 ppm mientras que no es acti-
vo si es mayor a 1000 ppm (23).
III. RESULTADOS
Separación e identicación de compuestos por croma-
tografía en capa na (TLC)
Al observar las placas de TLC, de las cinco fracciones
solamente se evidenciaron compuestos en la Fr1 y Fr2.
En las placas de TLC del extracto hexánico (gura 2) se
evidencian siete manchas que indican la posible presen-
cia de compuestos y en el TLC del extracto etéreo trece
Figura 2. Cromatografía en Capa Fina
del extracto hexánico
Figura 3. Cromatografía en Capa Fina
del extracto etéreo
(gura 3), las cuales presentan colora-
ciones y factores de retención (Rf acró-
nimo en inglés) similares.
Las coloraciones observadas en el re-
velado se deben al revelador utilizado
(ácido sulfúrico-vainillina), el cual al
reaccionar con un grupo fenol forma
manchas de colores naranja, amarillo,

17
Miranda, Vinueza, Acosta, Toaquiza, Méndez, Arias
marrón y morado. Según Ivor Smith
(1960), cada color tomado por los com-
puestos en las placas de TLC se debe a
que la reacción inicial sería la sustitución
electrofílica aromática de un fenol. Los
terpenos reaccionan con el ácido sul-
fúrico formando compuestos oxidados
y que en presencia de vainillina forma
cromógenos. Los cromógenos revelados
en ambas placas presentan similitud cro-
mática por lo que se determina que en
ambas extracciones se lograron extraer
compuestos similares; sin embargo, en
la placa del extracto etéreo se evidencia
la presencia de cinco compuestos adi-
cionales en comparación con la placa del
extracto hexánico. Esto se debe a que el
hexano extrae principalmente compues-
tos hidrófobos poco o nada polares con
una lipolia extremadamente alta, de los
cuales se esperan compuestos neutros
poco polares, esteroides y ácidos grasos
de alto contenido en carbono (15). En
cambio, el éter dietílico extrae principal-
mente compuestos hidrofóbicos medios
(incluidos compuestos ácidos y básicos
neutros de mediana y baja polaridad), de
los cuales se esperan esteroides, ceras,
ácidos grasos, alcaloides y polímeros
carbonatados de cadena polar (15).
Los valores de Rf determinados en am-
bas placas se consideran como “Rf. Al
comparar las distancias de recorrido de
cada placa TLC se determinó que exis-
ten coincidencias en ambas placas en
los compuestos que se encuentran en el
rango de Rf 0,24, 0,36, 0,53, 0,87, 0,96.,
Concentración
mg/L
Total larvas
vivas
Mortalidad (%)
Ensayo 1
Mortalidad (%)
Ensayo 2
Mortalidad (%)
Ensayo 3
0 100 7 6 9
31 100 13 15 12
62 100 33 30 35
125 100 50 52 55
500 100 63 66 65
1000 100 73 78 72
Mortalidad: % de larvas muertas
Concentración: mg/L de extracto
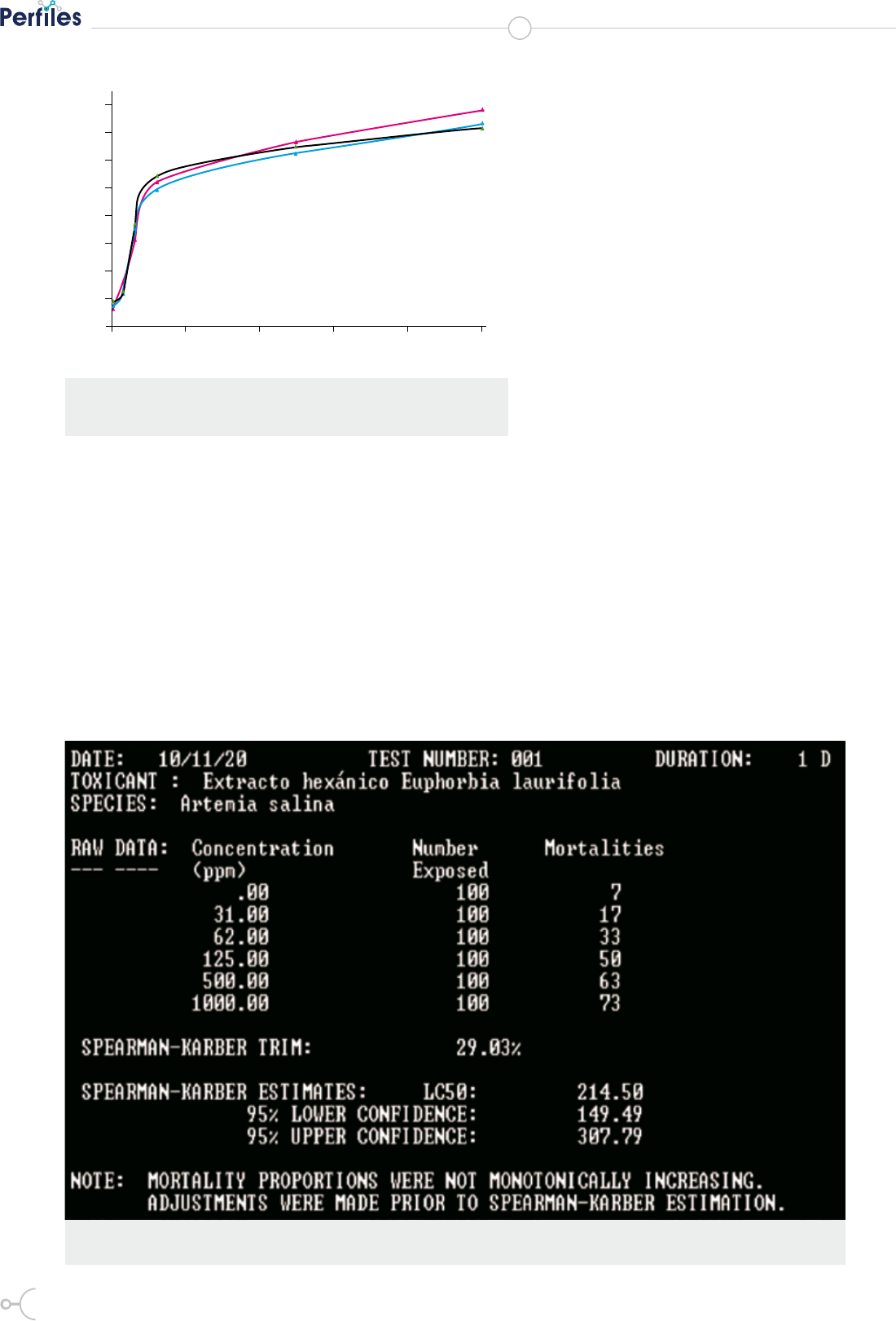
Tabla 1. Porcentaje de mortalidad del extracto hexánico de Euphorbia laurifolia sobre Artemia salina
identicando posibles compuestos terpenoides como el
borneol (Rf 0,24) y el cineol (Rf 0,40) (16).
En el resto de fracciones (Fr3, Fr 4, Fr5) no se identi-
caron compuestos terpénicos al someterlas a las mismas
condiciones.
Determinación de LC50 de la fracción
hexánica
Los resultados del efecto citotóxico del extracto hexá-
nico del látex de Euphorbia laurifolia frente a A. Salina
se encuentran detallados en la Figura 4 y Tabla 1, donde
se observa que al aumentar la concentración del extrac-
to existe igualmente un aumento de la mortalidad del
crustáceo, llegando hasta una disminución poblacional
máxima del 78 % a una concentración de 1000 mg/l. A
concentraciones inferiores a 200 ppm se puede observar
que el extracto es moderadamente tóxico, mientras que
a concentraciones superiores a 200 ppm el extracto es
altamente tóxico (22).
Por otro lado, el control, el cual presenta DMSO y no con-
tiene extracto, presenta porcentajes de mortalidad inferio-
res al 10 %, interpretándose como no tóxico (22). El hecho
de que se provoque cierta mortalidad sobre los nauplios
puede deberse a su gran propiedad transdérmica, lo que
podría provocar hipertonicidad en la A. salina (19).
La determinación de la dosis letal(LC50) a través del
software estadístico Análisis Probit TSK se realizó con
los valores promedios de los ensayos (gura 5), obte-
niendo un valor de 214.50 ppm a un nivel de conanza
del 95%, lo cual indica que el extracto hexánico del látex
de E. laurifolia es tóxico. Este resultado muestra el po-
tencial de esta especie vegetal como citotóxica y como
un posible agente antitumoral, siendo necesarios más es-
tudios al respecto (23).
La citotoxicidad de la fracción hexánica de E. laurifolia
fue menor en comparación con Neoboutonia macrocalyx
18
Revista Cientíca
ISSN 2477-9105
Número 20 Vol. 2 (2018)
(LC50 = 0.6 ppm), especie también perteneciente a la fa-
milia Euphorbiaceae (23). Igualmente, E. laurifolia fue
menos citotóxica que Euphorbia splendens (LC50=40
ppm) y Euphorbia aphylla (LC50=87,6 ppm) contra
Biomphalaria alexandrina (9). Por otra parte, Euphor-
bia helioscopia y Euphorbia schimperiana presentaron
valores de LC50 entre 34–66 ppm frente a Biomphalaria
pfeifferi (10).
80
70
60
50
40
30
20
10
0
Concentración del extracto (ppm)
0 200 400 600 800 1000
Mortalidad %
Figura 4. Porcentaje de mortalidad del extracto hexánico de
Euphorbia laurifolia sobre Artemia salina
Los terpenos son compuestos naturales
que muestran un amplio espectro de
efectos biológicos como la citotoxici-
dad. Son capaces de inhibir la vida de
células neoplásicas y producir apopto-
sis en células cancerosas, sin destruir
las células normales del organismo
(20). Asimismo, estos metabolitos son
considerados como toalexinas que
aumentan su concentración en las es-
pecies vegetales al verse afectadas por
algún agente externo (virus, bacterias,
hongos) (21).
IV. CONCLUSIONES
El látex de E. laurifolia presentó una
destacable diversidad de compuestos
terpénicos, identicando posibles com-
puestos como el borneol y el cineol. La
fracción hexánica del látex de la especie
en estudio presentó una notable toxici-
dad frente a Artemia salina, lo cual es
un indicio preliminar de su citoxicidad y
su potencial como agente antiparasitario
Figura 5. Resultados del LC50 a través del software estadístico Análisis Probit TSK

19
Miranda, Vinueza, Acosta, Toaquiza, Méndez, Arias
y/o antitumoral de importancia farma-
cológica. Es necesaria la realización de
otros estudios de toxicidad y de activi-
dad biológica, con el n de establecer su
seguridad y ecacia en el tratamiento de
enfermedades.
V. AGRADECIMIENTOS
A los autores que han contribuido en la investigación y
redacción del texto.
R
eferencias
1. Ávila L, Pérez M, Sánchez-Duffhues G, Hernández-Galán R, Muñoz E. Effects of Diterpenes From
Latex of Euphorbia lactea and Euphorbia laurifolia on Human Immunodeciency Virus Type 1 Reac-
tivation. Phytochemistry. 2010; 7: 243–248
2. Ahmed, A, Couladis, M., Mahmoud, A., De Adams, A., Mabry, T. Ingol diterpene ester from the latex
of Euphorbia lactea. Fitoterapia.1999; 70: 140–143.
3. Lu Z, Yang M, Zhang J, Chen G, Huang, H., Guan S, Ingenane diterpenoids from Euphorbia esula.
Phytochemistry. 2008; 69: 812–819.
4. Blanco-Molina M., Tron G, Macho A, Lucena C, Calzado M, Muñoz E, Appendino, G., Ingenol
Esters Induce Apoptosis in Jurkat Cells Through an AP 1 and NF-UB Independent Pathway. 2001; 8:
767–778
5. Vigone A, Tron G, Surico D, Baj G, Appendino G, Surico N. Ingenol Derivatives Inhibit Proliferation
and Induce Apoptosis in Breast Cancer Cell Lines. Eur. J. Gynaecol. Oncol. 2005; 26, 526–530.
6. Jijón C. Euphorbia laurifolia. [Internet]. 2014 [citado 12 noviembre 2014]; http://plantasnativas.
visitavirtualjbq.com/index.php?option=com_content&view=article&id=13:euphorbia-laurifolia&cati-
d=14:siglo-xviii-coleccion-de-joseph-de-jussieu&Itemid=108
7. Ulloa C, Moller P. Árboles y arbustos de los Andes. [Internet].2014[citado 11 noviembre 2014],http://
www.eoras.org/orataxon.aspx?ora_id=201&taxon_id=112355
8. Singh SK, Yadav RP, Singh, D, Singh, A. Toxic Effect of Two Common Euphorbiales latices on The
Freshwater Snail Lymnaea acuminate. Enviro Toxicol Pharmacol. 2004; 15: 87–93.
9. Hassan AA, Mahmoud AE, Hassan RA, Huseein EAM. Evaluation of Euphorbia aphylla, Ziziphus
spina-christi and Enterolobium contortisiliquum as Molluscicidal Agents. J Am Sci. 2011; 7: 511-20.
10. Al-Zanbagi NA, Banaja AEA, Barrett, J. Molluscicidal Activity of Some Saudi Arabian Euphorbia-
les Against the Snail Biomphalaria pfeifferi. J Ethnopharmacol. 2010; 70: 119–25.
11. Prashant Y, et al. Ijppr.Human, 2015; 4: 56-67
12. Mogollón-Morales JA, Nieves E, Rondón M, Rondón-Rivas ME. Propiedad molusquicida de Eu-
phorbia laurifolia A. Juss (Euphorbiaceae) contra Biomphalaria glabrata Say Hospedador Intermedia-
rio de Schistosoma mansoni. Avan Biomed 2016; 5: 83-9.
13. González J, Basabe P, Sexmero M, Sánchez Isidoro. Diterpenes From the Latex of Euphorbia bro-
teri.Phytochemistry 1988; 7: 207-212.
14. Smith I. Chromatographic and Electrophoretic Techniques. Zone Electrophoresis. 1960; 2: 200-215
15. Ferreira-Dias S, Valente D, Abreu J. Pattern Recognition of Acorns from Different Quercus Species
Based on Oil Content and Fatty Acid Prole. 2003; 54.
16. Wagner H, Blant S. Análisis de Medicamentos de plantas. 2.ª ed. Atlas de Cromatografía en capa
na. Springer. 1996: 315-350
17. Finney D, Probit analysis. 3.ª ed.,Cambridge University Press, UK. 1971; 1: 76-80.
18. Jaramillo B, Olivero J, Muñoz K. Composición química volátil y toxicidad aguda (Cl50) frente a
Artemia salina del aceite esencial del Croton malambo colectado en la costa norte colombiana. Scientia
et technica. 2007; 1: 299-302
20
Revista Cientíca
ISSN 2477-9105
Número 20 Vol. 2 (2018)
19. Ospina V, Mantilla J, Conde C, Escobar P. Permeación en piel humana de una nanoemulsión de
ftalocianina de aluminio clorada para la optimización de tratamientos tópicos de leishmaniasis cutánea.
Revista Ciencias de la Salud, 12(2), 2014: 195-211.
20. Chudzik M, Korzonek-Szlacheta I, Król W. Triterpenos como compuestos potencialmente citotóxi-
cos. Molecules. 2015; 20(1): 1610-1625
21. Zhao H-C, Wang, J-B. The Accumulation of Phytoalexin in Cucumber Plant After Stress. Colloids
and Surfaces B: Biointerfaces. 2005: 187-193.
22. Borroto J, Trujillo R, De la Torre Y, Waksman N, Hernández M y Salazar R. Actividad antimicro-
biana y toxicidad frente a Artemia salina del extracto diclorometánico de raíces de Morinda royoc L.
Revista Cubana de Plantas Medicinales. 2011:34-42.
23. Timoleon M, Pascal W, Ramsay S, Raduis M. Uzor P, Zulqar A. Terpenoids From the Stem Bark
of Neoboutonia macrocalyx (Euphorbiaceae). Phytochemistry Letters 2015; 12: 328–331