
34
ISSN 2477-9105 Número 22 Vol. 2 (2019)
NUEVAS FUENTES DE ANTIOXIDANTES NATURALES: CARACTERIZACIÓN
DE COMPUESTOS BIOACTIVOS EN CINCO FRUTOS NATIVOS DE CHILE.
1,2
ME. Romero Román*,
1
F. Noriega Vásquez,
1
M. Farías Villagra,
1
P. Jara Zapata,
1
B. Vera Flores,
1
MD. López Belchi
*mariaeugeromero@udec.cl
R
esumen
Palabras clave: berries, polifenoles, antocianinas, capacidad antioxidante, HPLC-DAD.
A
bstract
Berries from central and southern Chile were analyzed in order to find promising sources of
polyphenols with clear activity on human health. Five native fruits like arrayan, white strawberry,
murtilla and calafate, and a traditional berry (grape called “tintorera”) were studied. Antioxidant
properties were determined in vitro according to the total polyphenol assay of Folin Ciocalteu, an-
thocyanins by differential pH, antioxidant capacity by measuring the capacity of reduction of the
free radical 2.2-diphenyl-1-picrylhydracil (DPPH) and iron reducing capacity (FRAP) and chemi-
cal profile by HPLC-DAD. Calafate showed the highest value (1066.4 ± 24.9 mg gallic acid / 100g
sample) for total polyphenols and anthocyanins (1031.9 ± 48.1 mg of cyanidin-3-glucoside / 100g
of sample) followed by blue grape. Calafate displayed excellent reducing power (11279.2 ± 2027.4
μmol Trolox / 100g FRAP assay and 5235.0 ± 445.9, μmol / 100g in DPPH), followed by grape. The
chemical profile of anthocyanins showed delphinidin, cyanidin, malvidin, petunidin, peonidin
and pelargonidin in the five berries. Around 30 flavonols derived from quercetin, myricetin and
isorhamnetin were identified as well as ellagitannins present in white strawberry, very interesting
compounds for further studies. These results contribute to highlight the potential use of these be-
rries as functional foods.
Key words: berries, polyphenols, anthocyanins, antioxidant capacity, HPLC-DAD.
New source of natural antioxidants: Characterisation of bioactive compounds in ve
native Chilean fruits
Fecha de recepción: 29-08-2018 Fecha de aceptación: 17-06-2019
1
Universidad de Concepción, Facultad de Agronomía, Departamento de Producción Vegetal, Labo-
ratorio de Análisis Químico, Concepción, Chile
2
Universidad Técnica de Babahoyo, Facultad de Agronomía, Departamento de Biotecnología,
Babahoyo, Ecuador
Diferentes berries de la zona centro y sur de Chile fueron analizados con el fin de buscar fuentes
promisorias de polifenoles con clara actividad sobre la salud humana. Se estudiaron cinco bayas nativas:
arrayan, frutilla blanca, murtilla y calafate, y un berry tradicional (uva tintorera). Se determinó in vitro sus
propiedades antioxidantes según el ensayo de polifenoles totales de Folin Ciocalteu, antocianinas por pH
diferencial, capacidad antioxidante por medición de capacidad de reducción del radical libre 2.2-difenil-1-
picrilhidracilo (DPPH) y poder de reducción férrica (FRAP) y perfil químico por HPLC-DAD. De los cinco
berries, calafate registró el valor más alto (1066,4 ± 24,9 mg GAE/100g de muestra) para polifenoles totales
y antocianinas (1031,9 ± 48,1 mg de cianidina-3-glucósido/100g de muestra) seguido por uva tintorera.
Calafate presentó excelente poder reductor (11279,2 ± 2027,4 μmol Trolox/100g ensayo FRAP y 5235,0 ±
445,9, μmol/100g en DPPH). El perfil químico de antocianinas mostró delfinidina, cianidina, malvidina,
petunidina, peonidina y pelargonidina en los cinco berries. Alrededor de 30 flavonoles derivados de
quercetina, myricetina e isorhamnetina fueron identificados así cómo elagitaninos presentes en frutilla
blanca, compuestos muy interesantes para estudios posteriores. Estos resultados contribuyen a destacar el
uso potencial de estos berries como alimentos funcionales.

35
I. INTRODUCCIÓN
La relación entre salud y nutrición ha
puesto su atención en compuestos bioac-
tivos de los alimentos que puedan mejo-
rar las condiciones y calidad de vida (1).
La principal fuente de nutrientes son las
frutas, las cuales aportan vitaminas, mi-
nerales, proteína y fibra. Por otro lado,
gracias al metabolismo secundario, las
plantas producen compuestos como ca-
rotenoides, esteroles, glucosinolatos, po-
lifenoles, entre otros; (2,3) que le sirven
para protegerse frente a factores bióticos
y abióticos (4) y para la comunicación
alelopática (5). Las bayas o “berries” son
frutas caracterizadas por ser aromáticas
y poseer vistosos colores. Estas carac-
terísticas son otorgadas por algunos de
los metabolitos secundarios antes men-
cionados, producidos por estas frutas
como mecanismo de protección frente
a radiación y baja temperatura (5,6). En
diversos estudios se ha determinado que
dichos compuestos brindan beneficios
claros en nuestra salud, ya que tienen la
capacidad de evitar el estrés oxidativo
(7).
Si se considera el contenido de compues-
tos bioactivos, a la presente fecha, la pro-
moción del consumo de frutos rojos es
creciente, ya que los compuestos quími-
cos que ellas producen, están asociados
con la protección frente a enfermedades
degenerativas (8), crónicas (9), inflama-
torias (10), entre otras. En Chile, existe
una amplia diversidad de bayas que cre-
cen bajo distintas condiciones ecológi-
cas (11), sin embargo, algunas como el
arrayán o arrayana (Luma apiculata)
(12), calafate (Berberis microphylla) (13),
frutilla blanca (Fragaria chiloensis ssp.
chiloensis) (14) y murtilla (Ugni molinae)
(15) que, por su condición silvestre o
de semi-domesticación, su valor a nivel
agronómico, industrial, y nutracéutico
aún no ha sido explotado. A pesar de no
ser nativa, otra baya de importancia por
su representatividad en la cultura vitivi-
nícola chilena es la uva tintorera, que es uno de los pocos
cultivares de Vitis vinifera con una pulpa de bayas de co-
lor rojo, (cultivar teinturier) y que por su alto potencial
de intensidad de color se usa para mejorar vinos menos
coloreados (16).
En la mayoría de los berries comerciales se han encontra-
do antocianinas como delfinidina glicosilada, petunidi-
na, malvidina, peonidina y cianidina (17–19) , así como
ácido elágico, y elagitaninos en frutillas y fresas (20); mu-
chos de ellos están asociados con los efectos de los bene-
ficios de salud (9). La absorción de fuentes de polifenoles
asegura la eliminación de radicales libres y también au-
menta las propiedades cognitivas y previene o reduce el
riesgo de enfermedades neurodegenerativas (21)
Por los antecedentes se conoce que las bayas tienen una
producción considerable de metabolitos secundarios la
misma que está condicionada por los factores edafoclimá-
ticos que rodeen a la planta, así, el presente trabajo busca
destacar el potencial de cinco berries nativos chilenos del
centro y sur de Chile, para promoción de futuros trabajos
y generación de alimentos funcionales en relación a los
compuestos bioactivos de arrayan, calafate, murtilla, fru-
tilla blanca y uva tintorera.
II. MATERIALES Y MÉTODOS
Material vegetal
Se trabajó con bayas en estado óptimo de maduración co-
Figura 1. Berries en estudio y distribución en la zona centro y sur de Chile. A Uva tin-
torera (V. vinífera) B. Calafate (B. microphylla C. Arrayán (L. apiculata) D. Murtilla (U.
molinae) E). Frutilla blanca (F. chiloensis ssp. chiloensis).
Romero, Noriega, Farías, Jara, Vera, López

36
ISSN 2477-9105 Número 22 Vol. 2 (2019)
lectadas de la zona centro y sur de Chile: arrayana (Luma
apiculata) de Mulchén, Región de Bio-Bio, calafate (Ber-
beris microphylla) de Coyhaique, Región Aysén; frutilla
blanca (Fragaria chiloensis ssp.chiloensis) de Purén, Re-
gión de la Araucanía, murtilla (Ugni molinae) de Temu-
co, Región de la Araucanía y tintorera (Vitis vinífera) de
Quillón, Región de Ñuble (Fig. 1); y se mantuvieron a
-80°C en el Laboratorio de Química, Departamento de
Producción Vegetal de la Universidad de Concepción –
campus Chillan previo a su análisis.
Reactivos
Estándares comerciales de delfinidina-3-glucósido (98.84
%), cianidina3-glucósido (99.21 %), petunidin-3-glucó-
sido (99.90 %), malvidin-3-glucósido (99.91 %), Peoni-
din-3-glucósido (> 97 %), cianidina-3-lathyroside (> 97
%) de Sigma -Aldrich. El reactivo Folin-Ciocalteu, car-
bonato sódico (Na2CO3), buffer de cloruro de potasio
pH 1 y buffer acetato de sodio pH 4,5, el radical 2,2-di-
fenil-1-picrilhidracil (DPPH), Trolox, FeCl3-6H2O, HCl,
TPTZ por Merck (Alemania) y ácido fórmico, acetonitri-
lo, metanol y agua en grado HPLC de Merk.
Características físico-químicas y preparación de ex-
tractos
La determinación de las propiedades físico-químicas se
realizó a partir de frutos elegidos al azar. Se midieron
diámetros ecuatorial y polar de 20 berries por especie y
el peso en 100 frutos de cada una de las muestras. El pH,
solidos solubles y acidez se obtuvieron a partir de frutos
triturados, utilizando el pHmetro digital marca INOLAB
serie PH7110 para pH y la medición de solidos solubles
en °Brix utilizando un refractómetro SPER SCIENTIFIC
serie 300010. La acidez se determinó por titulación con
NaOH 0,1M a partir de 0,5 g de muestra triturada y di-
luida en 150 ml de agua destilada. La extracción de an-
tioxidantes se realizó por ultrasonido a partir de 0,5 g de
muestra en 5 ml de metanol/agua/acido fórmico (25:24:1
/ v: v: v) con 1 hora de ultrasonido, incubación a 0°C du-
rante 24h y posterior centrifugación a 3.500 rpm durante
15 minutos.
Determinación de polifenoles totales, antocianinas y
capacidad antioxidante
El análisis de polifenoles totales se realizó por el método
de Folin Ciocalteu (22), con una curva de calibración de
ácido gálico como estándar (0, 0.1, 0,25; 0,5 y 1 g/l) y
medición de la absorbancia de las muestras a una longi-
tud de onda de 760 nm a través de un espectrofotómetro
UV/vis Thermo Scientific; agregando a cada vial 120 μl
de reactivo de Folin Ciocalteu 1N, 25 μl
del extracto (muestra), 1,62 ml de agua
y finalmente 340 μl de la disolución de
carbonato de sodio al 20 %, y 2 horas de
incubación en oscuridad. El contenido
de polifenoles fue expresado en mg. de
equivalente ác. gálico /100g peso fresco
de muestra.
Para la determinación de antocianinas
totales se utilizó el ensayo de pH diferen-
cial con tampones de cloruro de potasio
0,025 M a pH 1 y acetato de sodio 0,4 M
a pH 4,5. (23) De cada extracto obtenido
previamente se extrajeron dos muestras
con 0,1 ml en dos tubos por separado se
agregó 2,9 ml de tampón KCl y al tubo 2
se adicionó 2,9 ml de tampón CH3CO-
2Na y se leyó la absorbancia a 510 y 700
nm de cada uno de los tubos (4 medidas
espectrofotométricas en total) en un es-
pectrofotómetro UV vis Thermo Scien-
tific™. Los datos se expresaron en mg de
cianidina-3-glucósido/100g de peso fres-
co.
El valor de capacidad antioxidante FRAP
se obtuvo con 30 µl del extracto, 300 µl
de agua destilada y la adición de 3000 µl
del reactivo FRAP (FeCl3-6H2O 20mM,
TPTZ10mM y tampón acetato 0,3mM)
incubados a 37 °C durante 30 min y me-
didos a 595 nm de absorbancia en el es-
pectrofotómetro antes descrito. El blan-
co fue agua destilada. Los resultados se
enunciaron como µmol trolox/100g de
muestra peso fresco. Respecto a la capa-
cidad antioxidante DPPH, se utilizó 100
µl del extracto y 2,9 ml de la solución
DPPH agitados constantemente y pos-
terior incubación en oscuridad durante
1 hora. Finalmente se realizó la lectura
a 515 nm. Los resultados se expresaron
en µmol trolox en100g de muestra peso
fresco. El blanco contenía 3 ml de me-
tanol.
Identificación y cuantificación de com-
puestos fenólicos por HPLC-DAD.
Los análisis HPLC-DAD para la identifi-

37
cación y cuantificación de polifenoles se
llevaron a cabo en una columna colum-
na Kromolith de fase inversa (RP) -18
(250-4,6 mm id) equipada con un detec-
tor de fotodiodos (DAD) (Merk-Hitachi,
Darmstadt, Alemania). con fase móvil
compuesto por dos disolventes: agua (A)
y ácido fórmico (B) (99:1, v/v) y caudal
de 1 ml/mincon variación del gradiente
de 8 % de disolvente B, 15 % a 25 min,
22 % a 55 min y 40 % a 60 min, man-
tenido hasta 70 min. Los compuestos se
identificaron por comparación con pa-
trones. Para los análisis cuantitativos,
se registraron los cromatogramas a 360
y 520 nm (Figura 2 y 3). Como están-
dares se utilizaron para las antocianinas
cianidina-3-glucósido a 520 nm y para
los flavonoles, quercetina-3-rutinósido a
360nm (Sigma Chemical Co. St. Louis,
MO).
Para determinar, polifenoles totales, an-
tocianinas totales y capacidad antioxi-
dante por los métodos FRAP y DPPH,
cada muestra se replicó tres veces y los
resultados se informan en medias ± des-
viación estándar y análisis de varianza
(ANOVA) con un nivel de significancia
p<0,05 y prueba de comparación de Tukey, utilizando el
programa estadístico SAS versión 8.0 para Windows.
III. RESULTADOS
Las características físico-químicas y preparación de ex-
tractos se presentan en la Tabla 1. Los resultados mues-
tran que el pH de los berries está entre 3,7 y 4,2. siendo
murtilla la más ácida y arrayan la más alcalina. Respecto
a los azucares totales, la frutilla posee 7,5 g/100g por ende
es la más dulce, seguido por calafate y uva tintorera. Es-
tas características confirman la posibilidad de aceptación
de estos berries para el consumo y aseguran el aprove-
chamiento de éstas en dietas sanas y/o la elaboración de
alimentos funcionales.
En la Tabla 2, se registra el valor más alto (1066,4 ± 24,9
mg ácido gálico /100g de muestra y 1031,9 ± 48,1 mg de
cianidina/100g de peso fresco) en polifenoles y antociani-
nas (respectivamente) en calafate superior a otros reportes
(24). Los valores menores en cuanto a polifenoles, se ob-
tuvieron para murtilla y frutilla blanca. Murtilla, presen-
tan un total de 260,5 ± 20,2 mg ác. gálico/100g muestra,
similar a otro reporte (15), mientras que, frutilla blanca
coincide con lo obtenido por otros investigadores (12).
Tabla 1 Comparación de características físico-químicas
de arrayan (L. apiculata), uva tintorera (V. vinífera), fruti-
lla blanca (F. chiloensis ssp. chiloensis), murtilla (U. moli-
nae) y calafate (B. microphylla) del centro y sur de Chile.
Fruto Peso (mg.) Diámetro
Ecuatorial (mm.)
Diámetro
Polar (mm.)
pH °Brix Azucares Totales
(g azúcar/100g)
Calafate 11,4 ± 0,6 c 10,00 ± 0,67 cd 7,81 ± 2,48 c 3,69 ± 0,06 c 27,1 ± 1,7 a 13,89 ± 0,45 b
Murtilla 12,5 ± 0,6 bc 9,93 ± 0,61 d 8,87 ± 0,47 c 3,67 ± 0,04 c 13,1 ± 0,6 c 8,24 ± 0,57 c
Uva 14,0 ± 0,6 bc 12,53 ± 1,09 b 14,02 ± 0,95 b 4,09 ± 0,05 ab 23,6 ± 1,0 b 14,45 ± 2,01 b
Arrayan 20,0 ± 0,4 b 12,12 ± 1,68 bc 12,12 ± 1,51 b 4,21 ± 0,08 a 9,6 ± 0,4 d 5,23 ± 0,46 c
Frutilla blanca 96,9 ± 6,6 a 32,43 ± 3,17 a 29,5 ± 3,26 a 3,97 ± 0,06 b 11,6 ± 0,4 cd 40,74 ± 2,12 a
Tabla 1. *Peso medido en mg. y los diámetros polar y ecuatorial en mm. Letras diferentes indican diferencias signicativas entre valores de la misma co-
lumna (p> 0.05).
En cuanto a capacidad antioxidante,
los resultados (Tabla 2) demuestran que
calafate posee el más alto poder reduc-
tor de radicales libre mediante método
FRAP (11279,2 ± 2027,4 μmol/100g); si-
milares datos han sido alcanzados pre-
viamente (13).
Para el radical DPPH, los mejores re-
sultados son calafate (5235,0 ± 445,9 a
μmol/100g.), arrayan (4401,7 ± 493,9)
y uva tintorera (4335,0 ± 156,1 μmol/100g). Los valores
para tintorera son superiores a lo reportado para uvas co-
merciales (27).
Tabla 2. Polifenoles totales, antocianinas totales, y capa-
cidad antioxidante por medición del poder de reducción
del radical libre DPPH y reducción férrica (FRAP) en ar-
rayan (L. apiculata), uva tintorera (V. vinífera), frutilla
blanca (F. chiloensis ssp. chiloensis), murtilla (U. moli-
nae) y calafate (B. microphylla) del centro y sur de Chile.
Romero, Noriega, Farías, Jara, Vera, López
38
ISSN 2477-9105 Número 22 Vol. 2 (2019)
Tabla 2. *Letras diferentes indican diferencias signicativas entre valores de la misma columna (p> 0.05).
Tabla 1. *Peso medido en mg. y los diámetros polar y ecuatorial en mm. Letras diferentes indican diferencias signicativas entre valores de la misma co-
lumna (p> 0.05).
Fruto
Polifenoles Totales
mg ác. gálico/100g
muestra
Antocianinas Totales
mg de cianidina/100g peso
fresco
DPPH
μmolTrolox /100g peso
fresco
FRAP
μmolTrolox/100g peso
fresco
Calafate 1066,4 ± 24,9 a 1031,9 ± 48,1 a 5235,0 ± 445,9 a 11279,2 ± 2027,4 a
Murtilla 260,5 ± 20,2 c 8,8 ± 1,2 d 2005,8 ± 848,6 b 5445,8 ± 316,6 a
Uva tintorera 639,5 ± 41,8 b 438,2 ± 12,0 b 4335,0 ± 156,1 a 3262,5 ± 288,3 bc
Arrayan 464,4 ± 31,6 c 287,7 ± 11,4 c 4401,7 ± 493,9 a 2104,2 ± 344,9 c
Frutilla blan-
ca
273,4 ± 18,4 c 3,8 ± 0,4 d 2800,8 ± 175,3 b 1343,0 ± 250,0 c
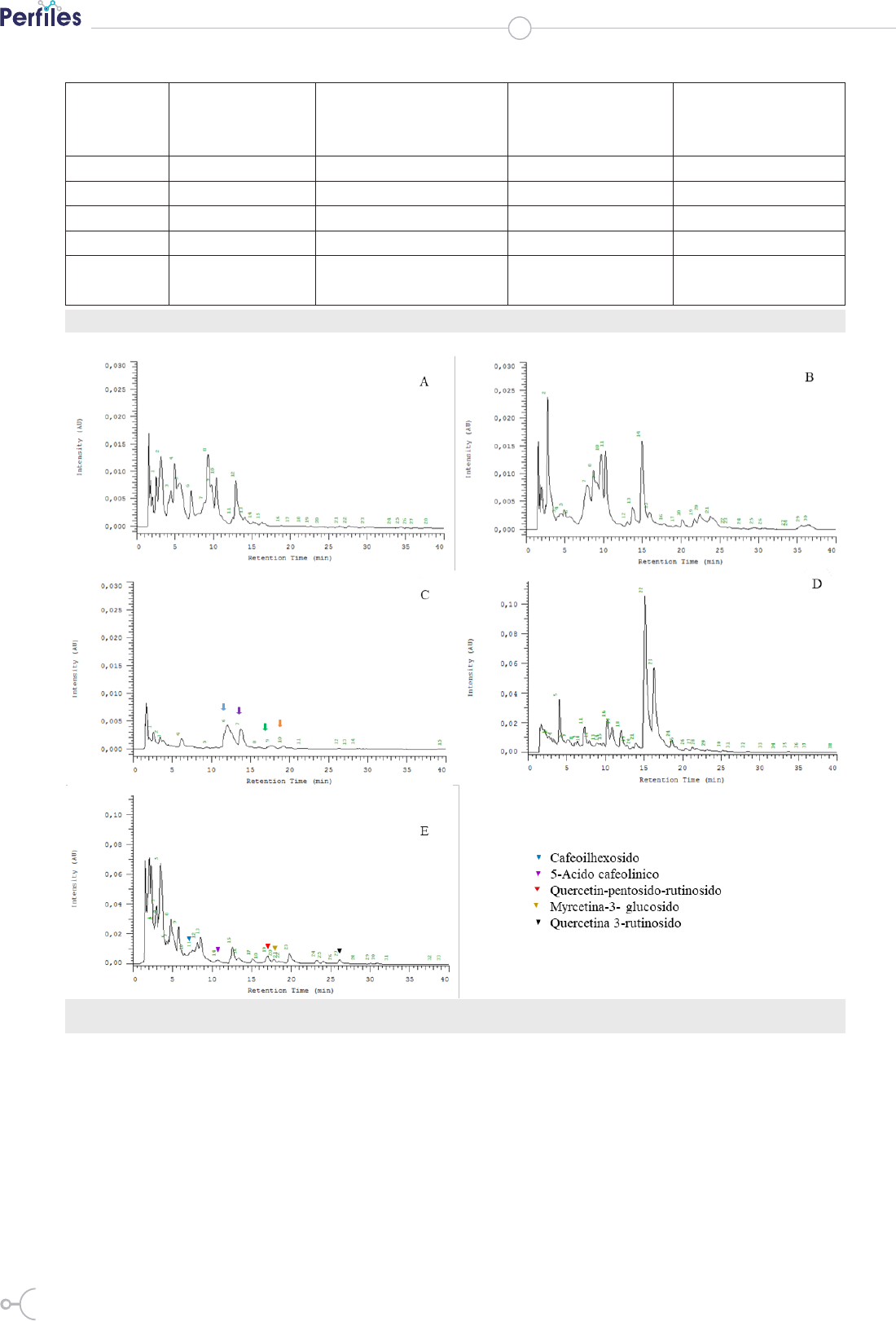
El perfil químico (Fig. 2), a longitud de onda 360nm
muestra diferencias en los cromatogramas generando
más de 30 posibles flavonoles. Se reportaron 26 flavono-
les principalmente quercetina y myricetina para berries
similares a los utilizados en este estudio (26). La Fig. 2-C
muestra el cromatograma de frutilla blanca donde se han
marcado compuestos que esta fruta posee pero que no se
identificaron. Estos pudieran corresponder a elagitaninos
(ácido elágico, glucósidos de ác. elágico y elagitaninos),
además de pelargonidin-3-glucósido y
cianidina-3-glucósido como describen
otros investigadores (20) y similar a otro
reporte donde a partir de fruta liofili-
zada se encontraron 2,12 mg de quer-
cetina/g. (27) como parte de los ácidos
hidroxicinámicos (elagitaninos) y que
presentan evitan daños cardiovasculares
y cáncer (28).

39
Figura 3. Cromatogramas HPLC-DAD, longitud de onda 520 nm. A Arrayan (L. apiculata) B. Tintorera (V. vinífera) C. Frutilla blanca (F. chiloensis
ssp. chiloensis) D. murtilla (U. molinae) y E. calafate (B. microphylla).
En el presente estudio para los 5 berries
mediante HPLC-DAD se identificaron 9
antocianinas a partir de extractos, todas
ellas variantes glucosiladas de cianidi-
na, delfinidina, malvidina, peonidina,
petunidina y pelargonidina. Los cro-
matogramas individuales constan en la
Figura 3. Estos resultados son similares
a los reportados en otras investigaciones
donde se menciona que los compuestos
predominantes en todos los berries co-
mestibles son malvidina-3-glucósido,
cumarato de malvidina-3-glucósido y
la delfinidina-3-glucósido (24) (17) y se
destaca este último presente en calafa-
te (Fig. 3-E) que se encuentra en mayor
cantidad respecto a las otras bayas (27).
IV. DISCUSIÓN
Según la FAO, en frutas el pH 3,5 es el
mínimo requerido para la aceptación y
consumo (29); en consecuencia, todas
Romero, Noriega, Farías, Jara, Vera, López
las frutas analizadas en este trabajo pueden tener alta
probabilidad de ser aceptadas por los consumidores. Los
grados Brix (entre 5 y 20) y alto contenido de azúcares to-
tales son indicadores de madurez y calidad gustativa (30)
en este calafate y uva tintorera sobresalen. Por otro lado,
algunas antocianinas se enlazan con diferentes azúcares
(2), lo que indica que la presencia de altos contenidos de
azúcar podría potenciar el efecto de dichos flavonoides
frente al estrés oxidativo.
La caracterización de diferentes tipos de frutas y su con-
tenido de componentes antioxidantes específicos respon-
de a la orientación actual de consumo de alimentos que
contengan compuestos bioactivos y presenten beneficios
a la salud (3). Los resultados respecto a polifenoles y anto-
cianinas en calafate mostraron valores superiores a otros
reportes (24). Así mismo, se pudo constatar que todos los
berries en estudio poseen contenidos de compuestos fe-
nólicos considerables, incluso superiores a los resultados
reportados para bayas comerciales como en el caso de uva
tintorera (639,5 ± 41,8) frente a lo probado para uvas co-
merciales 460,45 ± 45 mg ácido gálico /100g de muestra
(17).

R
eferencias
40
ISSN 2477-9105 Número 22 Vol. 2 (2019)
Así, el poder reductor de estas bayas es promisorio. Las
diferencias en las cuantificaciones analíticas, respecto
al poder reductor de las frutas nativas chilenas compa-
rado con los valores obtenidos por otros investigadores
se debe a que la cantidad de polifenoles totales como de
antocianinas totales depende de diversos factores medio
ambientales, localidad de recolección, etapa de madura-
ción, especie, tipo de cultivo, entre otros (31). De igual
forma, trabajos previos (9,10,32) demuestran que las an-
tocianinas tienen efectos beneficiosos para el tratamiento
de enfermedades crónicas, por ello, la referencia en tér-
mino de estos compuestos es importante para continuar
con estudios tanto in vitro como in vivo respecto a las
propiedades neuroprotectoras, cardioprotectoras, antiin-
flamatorias y anticancerígenas que estos berries pudieran
ofrecer.
V. CONCLUSIONES
Estos resultados preliminares indican que los perles
de antocianinas de las cinco 5 bayas recolectadas de la
región centro y sur de Chile mostraron un alto predo-
minio de antocianinas (delnidina y derivados de ciani-
dina). Calafate (B. microphylla) es la baya que mostró los
niveles más altos de antocianinas totales y actividad an-
tioxidante por el método FRAP y DPPH seguida de uva
tintorera y arrayan. Por su parte murti-
lla y frutilla blanca, a pesar de mostrar
cantidades menores de antocianinas y
polifenoles, gracias al estudio del per-
l químico, se encontraron compuestos
que podrían ser de interés para estu-
dios posteriores como los elagitaninos
en frutilla blanca (F. chiloensis ssp. chi-
loensis). Estos frutos ricos en compues-
tos polifenólicos tienen un futuro pro-
metedor para ser incorporados como
ingredientes funcionales, por lo que es
meritorio continuar con el estudio de
estas bayas.
VI. AGRADECIMIENTOS
Reconocimiento y gratitud al Labora-
torio de Análisis Químico del Depar-
tamento de Producción Vegetal de la
Universidad de Concepción, campus
Chillán, a CONICYT FONDECYT
1160899 de Chile y, al Instituto de Fo-
mento al Talento Humano y Secretaria
de Educación Superior de Ciencia, Tec-
nología e Innovación de Ecuador.
1. Blasa M, Gennari L, Angelino D, Ninfali P. Chapter 3 - Fruit and Vegetable Antioxidants in Health. In:
Watson RR, Preedy VR, editors. Bioactive Foods in Promoting Health [Internet]. San Diego: Academic Press;
2010. p. 37–58. Available from: http://www.sciencedirect.com/science/article/pii/B9780123746283000037
2. Amalesh S, Kumar S, Das G. Roles of flavonoids in Plants. ResearchGate [Internet]. 2011 [cited 2018 Apr 23];
Available from: https://www.researchgate.net/publication/279499208_Roles_of_flavonoids_in_Plants
3. Panche AN, Diwan AD, Chandra SR. Flavonoids: an overview. J Nutr Sci [Internet]. 2016 Dec 29 [cited 2018
Apr 24];5. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5465813/
4. Ncube B, Van Staden J. Tilting Plant Metabolism for Improved Metabolite Biosynthesis and Enhanced Hu-
man Benefit. Molecules. 2015 Jul 13;20(7):12698–731.
5. Mewis I, Schreiner M, Nguyen CN, Krumbein A, Ulrichs C, Lohse M, et al. UV-B Irradiation Changes
Specifically the Secondary Metabolite Profile in Broccoli Sprouts: Induced Signaling Overlaps with Defense
Response to Biotic Stressors. Plant Cell Physiol. 2012 Sep;53(9):1546–60.
6. Eichholz I, Huyskens-Keil S, Keller A, Ulrich D, Kroh LW, Rohn S. UV-B-induced changes of volatile me-
tabolites and phenolic compounds in blueberries (Vaccinium corymbosum L.). Food Chem [Internet]. 2011;
Available from: http://agris.fao.org/agris-search/search.do?recordID=US201301920818
7. Neal M, Richardson JR. Time to get personal: A framework for personalized targeting of oxidative stress in
neurotoxicity and neurodegenerative disease. Curr Opin Toxicol. 2018 Feb 1;7:127–32.
8. Walker LC, Jucker M. Neurodegenerative Diseases: Expanding the Prion Concept. Annu Rev Neurosci.
2015;38(1):87–103.
9. Yang L, Ling W, Du Z, Chen Y, Li D, Deng S, et al. Effects of Anthocyanins on Cardiometabolic Health:
A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Adv Nutr Bethesda Md. 2017
Sep;8(5):684–93.
10. Spagnuolo C, Moccia S, Russo GL. Anti-inflammatory effects of flavonoids in neurodegenerative disor-
ders. Eur J Med Chem. 2018 Jun 10;153:105–15.
11. Varas B, Castro MH, Rodriguez R, von Baer D, Mardones C, Hinrichsen P. Identification and characteri-
zation of microsatellites from calafate (Berberis microphylla, Berberidaceae)1. Appl Plant Sci [Internet]. 2013

41
Jul 5 [cited 2018 May 5];1(7). Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4103124/
12. Simirgiotis MJ, Schmeda-Hirschmann G. Determination of phenolic composition and antioxidant activi-
ty in fruits, rhizomes and leaves of the white strawberry (Fragaria chiloensis spp. chiloensis form chiloensis)
using HPLC-DAD–ESI-MS and free radical quenching techniques. J Food Compos Anal. 2010;23(6):545–53.
13. Mariangel E, Reyes-Diaz M, Lobos W, Bensch E, Schalchli H, Ibarra P. The antioxidant properties of ca-
lafate (Berberis microphylla) fruits from four different locations in southern Chile. Cienc E Investig Agrar.
2013 Apr;40(1):161–70.
14. Simirgiotis MJ, Bórquez J, Schmeda-Hirschmann G. Antioxidant capacity, polyphenolic content and tan-
dem HPLC–DAD–ESI/MS profiling of phenolic compounds from the South American berries Luma apicu-
lata and L. chequén. Food Chem. 2013 Aug 15;139(1):289–99.
15. Junqueira-Gonçalves MP, Yáñez L, Morales C, Navarro M, A. Contreras R, Zúñiga GE. Isolation and
Characterization of Phenolic Compounds and Anthocyanins from Murta (Ugni molinae Turcz.) Fruits. As-
sessment of Antioxidant and Antibacterial Activity. Molecules. 2015 Mar 31;20(4):5698–713.
16. Figueiredo-González M, Regueiro J, Cancho-Grande B, Simal-Gándara J. Garnacha Tintorera-based sweet
wines: Detailed phenolic composition by HPLC/DAD–ESI/MS analysis. Food Chem. 2014 Jan 15;143:282–92.
17. Burin B, Falcao L, Valdemoro L. Color, contenido fenólico y actividad antioxidante del jugo de uva. Ciênc
Tecnol Aliment. 2010;30(4):1–6.
18. Lee J, Durst RW, Wrolstad RE. Determination of total monomeric anthocyanin pigment content of fruit
juices, beverages, natural colorants, and wines by the pH differential method: collaborative study. J AOAC Int.
2005 Oct;88(5):1269–78.
19. Prior RL, Lazarus SA, Cao G, Muccitelli H, Hammerstone JF. Identification of Procyanidins and Antho-
cyanins in Blueberries and Cranberries (Vaccinium Spp.) Using High-Performance Liquid Chromatography/
Mass Spectrometry. J Agric Food Chem. 2001 Mar 1;49(3):1270–6.
20. Aaby K, Skrede G, Wrolstad R. Antioxidant Activities in Flesh and Achenes of Strawberries (Fragaria
ananassa). J Agric Food Chem. 2005;53(10):4032–40.
21. Mathew M, Subramanian S. In Vitro Screening for Anti-Cholinesterase and Antioxidant Activity of
Methanolic Extracts of Ayurvedic Medicinal Plants Used for Cognitive Disorders. PLOS ONE. 2014 Jan
23;9(1):e86804.
22. Singleton VL, Rossi JA. Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid
Reagents. Am J Enol Vitic. 1965 Jan 1;16(3):144–58.
23. Fuleki T, Francis F. Quantitative methods for anthocyanins. 1. Extraction and determination of total an-
thocyanin in cranberries. J Food Sci. 1968;33(1):72–7.
24. Brito A, Areche C, Sepúlveda B, Kennelly EJ, Simirgiotis MJ. Anthocyanin Characterization, Total Phe-
nolic Quantification and Antioxidant Features of Some Chilean Edible Berry Extracts. Molecules. 2014 Jul
28;19(8):10936–55.
25. Castro-López C, Rojas R, Sánchez-Alejo EJ, Niño-Medina G, Martínez-Ávila GCG. Phenolic Compounds
Recovery from Grape Fruit and By- Products: An Overview of Extraction Methods. In: Morata A, Loira I, edi-
tors. Grape and Wine Biotechnology [Internet]. Rijeka: InTech; 2016 [cited 2018 Mar 13]. p. Ch. 05. Available
from: http://dx.doi.org/10.5772/64821
26. Ruiz A, Bustamante L, Vergara C, von Baer D, Hermosín-Gutiérrez I, Obando L, et al. Hydroxycinnamic
acids and flavonols in native edible berries of South Patagonia. Food Chem. 2015 Jan 15;167:84–90.
27. Lopez MD, Romero ME, Vera B. El calafate. Su industrialización abre nuevas perspectivas. Indualimentos
[Internet]. 2018 abil;110. Available from: http://www.indualimentos.cl/edic.html
28. Larrosa M, García-Conesa MT, Espín JC, Tomás-Barberán FA. Ellagitannins, ellagic acid and vascular
health. Mol Aspects Med. 2010 Dec 1;31(6):513–39.
29. FAO. Agricultura mundial: hacia los años 2015/2030 [Internet]. 2015 [cited 2017 Jul 27]. Available from:
http://www.fao.org/docrep/004/y3557s/y3557s06.htm
30. Cárdenas G, Arrazola G, Villalba M. Frutas tropicales: fuente de compuestos bioactivos naturales en la
industria de alimentos-Tropical Fruits: Source of Natural Compounds Bioactives Food Industry | Cárdenas
Baquero | Ingenium Revista de la facultad de ingeniería. 2016 [cited 2017 Nov 28]; Available from: http://revis-
tas.usb.edu.co/index.php/Ingenium/article/view/2152
31. Ruiz A, Hermosín-Gutiérrez I, Vergara C, von Baer D, Zapata M, Hitschfeld A, et al. Anthocyanin profiles
in south Patagonian wild berries by HPLC-DAD-ESI-MS/MS. Food Res Int. 2013 May 1;51(2):706–13.
32. Wightman JD, Heuberger RA. Effect of grape and other berries on cardiovascular health. J Sci Food Agric.
2015;95(8):1584–97.
Romero, Noriega, Farías, Jara, Vera, López