
33
SÍNTESIS Y APLICACIÓN DEL COMPUESTO DE COORDINACIÓN:
TRIOXALATOFERRATO (III) DE POTASIO
Synthesis and application of the coordination compound: potassium trioxalatoferrate (III)
Valeria Tapia-González*, María-José Tobar-Heredia, Gabriela Acurio-Pruna, Amarilis Betún-Gua-
mán, Noella Basurto-Pinargote
Escuela Superior Politécnica de Chimborazo, Facultad de Ciencias, Escuela de Ingeniería Quími-
ca, Riobamba, Ecudor.
*ztapia@espoch.edu.ec
R
esumen
El estudio de los compuestos de coordinación constituye un aspecto fundamental dentro del campo
de la química inorgánica debido a la naturaleza fascinante que poseen manifestada en sus propiedades
particulares que les permiten tener utilidad a nivel industrial. El presente trabajo de investigación se enfoca
en la síntesis y caracterización del trioxalatoferrato (III) de potasio para su aplicación factible. La síntesis
del compuesto se realizó en el laboratorio en base a un conjunto de reacciones químicas progresivas de
ácido oxálico, hidróxido de potasio y cloruro de hierro (III) para la preparación de una disolución de la
cual se obtuvieron cristales del compuesto estudiado gracias al proceso de precipitación en ambiente sin
luz. Los cristales fueron separados de la disolución a través del sistema de filtración por gravedad para su
caracterización por espectroscopia de infrarrojo y finalmente su aplicación en la técnica de copia fotográfica
monocromática. Los resultados de la investigación muestran que la capacidad de fotorreducción propia del
ion Fe
+3
contenido en el compuesto de coordinación estudiado le permite tener un aporte y utilidad en la
industria de la fotografía como elemento para la preparación de tinta fotográfica.
Palabras clave: compuesto de coordinación, cristales, hierro, reducción química
A
bstract
The study of coordination compounds is a fundamental aspect in the field of inorganic chemistry
due to the fascinating nature they have manifested in their particular properties that allow them
to have numerous industrial applications. This paper focuses on the synthesis and characteriza-
tion of potassium trioxalatoferrate (III) for feasible application. The synthesis of the compound
was carried out at the laboratory with a set of progressive chemical reactions of oxalic acid, po-
tassium hydroxide and iron chloride (III) for the preparation of a solution from which crystals
of the studied compound were obtained due to the process of precipitation in an environment
without light. The crystals were separated from the solution through the gravity filtration system
for its characterization by infrared spectroscopy and finally its application in the monochromatic
photographic technique. The results of the investigation show that photoreduction capacity of the
Fe
+3
ion contained in the compound studied allows it to have a contribution and to be useful in the
photography industry as an element for the preparation of photographic ink.
Key words: coordination compound, crystals, iron, chemical reduction.
Fecha de recepción: 16-07-2019 Fecha de aceptación: 23-12-2019
I. INTRODUCCIÓN
Los compuestos de coordinación se presentaban
como sustancias de características muy particu-
lares y de naturaleza asombrosa en los inicios de
la historia de la química inorgánica porque pare-
cían desafiar las reglas comunes del número de
valencia de ciertos metales al formar compues-
tos (1). Fue el científico Alfred Werner quien en
1893 presentó la teoría de la coordinación la cual
Tapia, Tobar, Acurio, Betún, Basurto

34
ISSN 2477-9105 Número 23 Vol.1 (2020)
explicó que ciertos átomos metálicos al formar
compuestos y actuar como núcleos centrales
pueden utilizar valencias auxiliares (2).
Un compuesto de coordinación es una estructu-
ra química formada por un ion complejo y uno
o varios contraiones (iones con carga opuesta).
Este ion complejo posee un átomo central que
corresponde a un metal de transición que se en-
cuentra unido a una o diversas moléculas deno-
minadas ligandos (2). La importancia del estudio
de los compuestos de coordinación radica en las
propiedades físicas y químicas que presentan
entre las que sobresalen: colores intensos, para-
magnetismo simple y estructuras cristalinas bien
definidas que les permiten tener un gran número
de aplicaciones a nivel industrial, entre ellas des-
tacan: secuestro de iones metálicos, extracción y
separación de metales, colorantes textiles, cata-
lizadores en procesos de hidrogenación y oxida-
ción (3).
Otro aspecto interesante de los compuestos de
coordinación es su importancia a nivel biológi-
co debido a que constituyen parte esencial de la
estructura de enzimas que actúan como cataliza-
dores en los sistemas biológicos por lo que estas
sustancias también poseen aplicaciones terapéu-
ticas como: tratamiento del cáncer, artritis y en-
venenamientos (4).
El presente trabajo de investigación tiene como
objetivo principal el estudio de las propiedades
físicas y químicas del compuesto de coordinación
trioxalatoferrato (III) de potasio, a través de su
síntesis y caracterización, para su aplicación en
la técnica de copiado fotográfico monocromático
conocida como cianotipia que es posible gracias
a una característica propia del hierro, un compo-
nente del ion complejo que le permite reaccionar
de forma interesante cuando entra en contacto
directo con una fuente de radiación ultraviole-
ta como la luz solar. Los objetivos específicos de
este trabajo se fundamentan en la obtención de
cristales de trioxalatoferrato (III) de potasio en
el laboratorio químico en base a la práctica rea-
lizada por el autor Castro (3), profesor de la Fa-
cultad de Ciencias la Universidad del Valle en el
año 2016, la identificación de las reacciones invo-
lucradas en la formación del compuesto de coor-
dinación y la propuesta final de una aplicación
factible para el compuesto obtenido.
II. MATERIALES Y MÉTODOS
Para el estudio, primero se realizó la síntesis del
compuesto de coordinación en el Laboratorio de
Química General e Inorgánica de la Escuela Su-
perior Politécnica de Chimborazo, en base a la
práctica realizada por el autor Castro (3) en la
Facultad de Ciencias de la Universidad del Valle
(Colombia) en el año 2016. Los reactivos con sus
respectivas cantidades y unidades se presentan
en la Tabla 1.
REACTIVOS MARCAS CANTIDADES
Agua destilada Prolabor 80 ml
Ácido oxálico Fisher Scientic 37.8 g
Hidróxido de potasio Emsure 33.6 g
Cloruro de hierro (III) Prolabor 16.2 g
Etanol al 98% Prolabor 50 ml
Tabla 1. Reactivos para la obtención de cristales
de trioxalatoferrato (III) de potasio
Fuente: Castro (3)
La obtención de cristales de trioxalatoferrato
(III) de potasio se fundamenta en la reacción de
precipitación que permite obtener precipitados
sólidos en una disolución gracias a reacciones
químicas. En esta técnica de síntesis, el precipi-
tado obtenido se recuperó como cristales color
verde esmeralda. En la práctica de laboratorio se
trabajó en base a la preparación de disoluciones
donde el solvente fue el agua destilada a punto
de ebullición. Los reactivos fueron añadidos gra-
dualmente en un vaso de precipitación con agua
en el siguiente orden: ácido oxálico, hidróxido de
potasio y cloruro de hierro.
La disolución fue preparada con ayuda de una
plancha de calentamiento y con agitación ma-
nual constante para la obtención de una disolu-
ción homogénea. Cabe destacar que cada reactivo
debe ser añadido por etapas y cuando cada uno
haya sido disuelto completamente en agua se po-
drá añadir el siguiente. En esta práctica hay una
reacción exotérmica cuando la solución de ácido
oxálico entra en contacto con el hidróxido de so-
dio por tanto este último debe ser incorporado
lentamente para evitar ocasionar una reacción
química extremadamente violenta y también es
35
necesario bajar la temperatura de calentamiento
al mínimo mientras se agita.
El cloruro de hierro permite obtener finalmen-
te una disolución color verde claro que debe en-
friarse a temperatura ambiente, en un lugar sin
presencia de luz porque de lo contrario el hierro
sufrirá una reacción prematura de reducción
química impidiendo la precipitación de los cris-
tales. Luego de dejar reposar la disolución duran-
te 24 horas se procede a la filtración por gravedad
donde el etanol se emplea para lavar los cristales
recuperados por el papel filtro.
La siguiente etapa es de secado para eliminar el
exceso de agua presente en los cristales por lo que
se empleó un secador de bandejas con una tem-
peratura de 65 °C en un tiempo de 45 minutos
con el propósito de reducir la presencia de agua
en el compuesto.
Reacciones químicas en el proceso de síntesis
Tabla 2. Reacciones por pasos para la formación de trioxalatoferrato (III)
de potasio.
En la primera reacción los iones hidroxilo del
hidróxido de potasio se disocian en el agua y re-
accionan con el ácido oxálico para formar iones
oxalato en medio acuoso. Luego los iones de hie-
rro (III) del tricloruro de hierro forman un ion
complejo con los iones oxalato en medio acuo-
so en la segunda reacción. Finalmente, los iones
complejos de trioxalatoferrato (III) se unen con
los iones K
+
disociados en el agua para formar
el compuesto de coordinación trisoxalatoferrato
(III) de potasio en la tercera reacción. El com-
puesto de coordinación se presenta trihidratado
debido a que cada ion oxalato se enlaza con una
molécula de agua (fórmula 4).
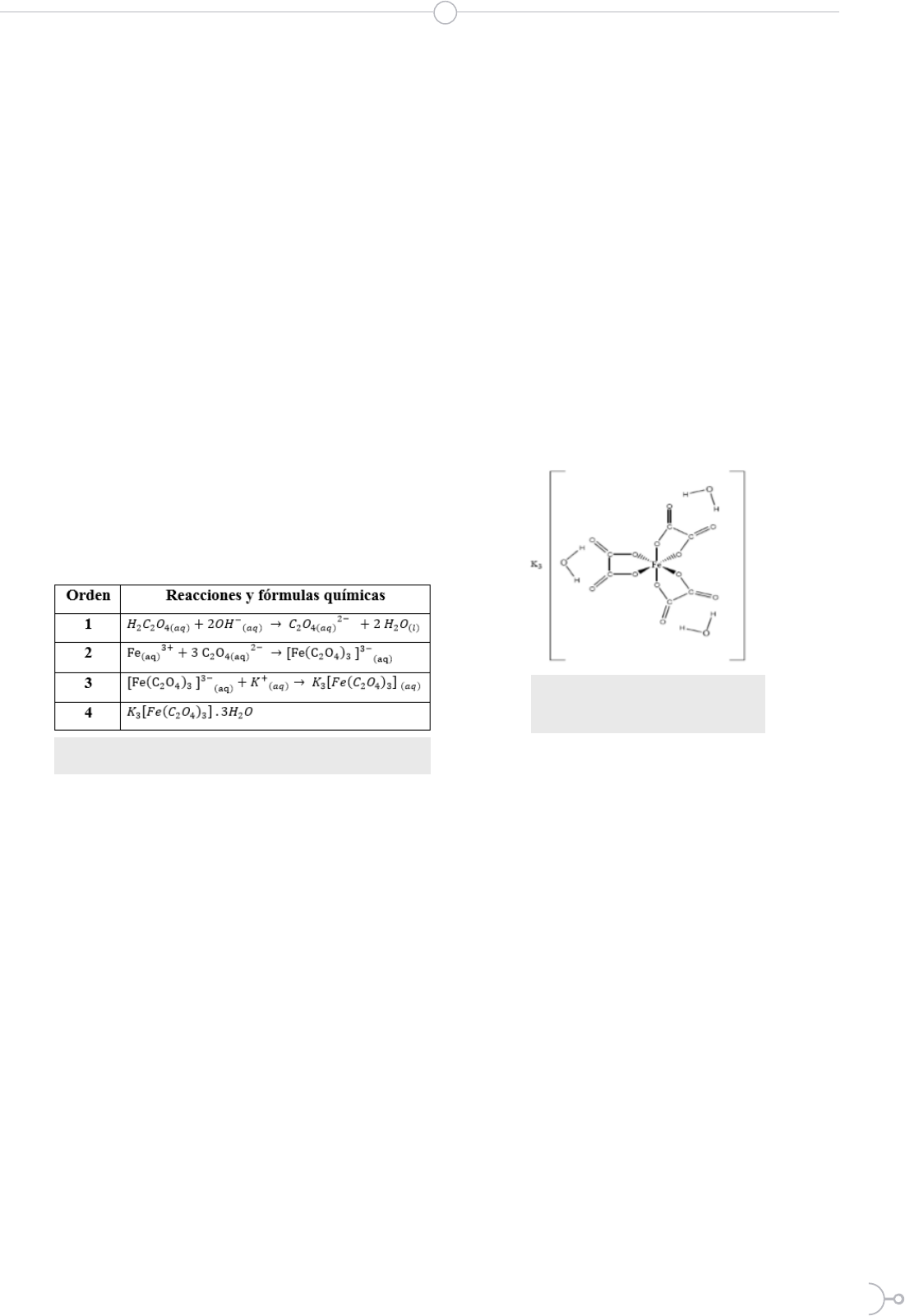
Trioxalatoferrato (III) de potasio: Estructura y
propiedades
El complejo de coordinación trioxalatoferrato
(III) de potasio está formado por el anión com-
plejo trioxalatoferrato (III) de geometría octaé-
drica y el catión potasio con número de oxida-
ción +1. Este complejo se caracteriza por poseer
un color verde intenso. En la Figura 1 se puede
observar la estructura química del compuesto,
cada ion oxalato se encuentra unido al átomo
central por medio de dos átomos de oxígeno que
actúan como átomos donadores. Los oxalatos
por lo tanto son ligandos bidentados y hay un
total de seis átomos de oxígeno unidos al átomo
central por lo cual el número de coordinación del
complejo es seis.
Cada oxalato conforma un anillo quelato que
consta de cinco átomos donde dos son de carbo-
no, dos de oxígeno y el átomo central metálico es
hierro con estado de oxidación: +3 (4).
Figura 1. Estructura química del trioxalatofe-
rrato (III) de potasio
Fuente: Castro (3)
Espectroscopia Infrarroja
Es un método empleado para la caracterización
e identificación de ciertas sustancias y grupos
funcionales presentes en compuestos químicos
donde las vibraciones moleculares producen
oscilaciones en las cargas eléctricas que emiten
longitudes de onda que perminten analizar e
identificar los tipos de enlaces presentes en una
sustancia y en este caso el complejo de coordina-
ción. Una molécula absorberá la energía de un
haz de luz infrarroja cuando dicha energía inci-
dente sea igual a la necesaria para que se dé una
transición vibracional de la molécula. Es decir, la
molécula comienza a vibrar de una determinada
manera gracias a la energía que se le suministra
mediante luz infrarroja (5).
Para la caracterización del compuesto se utilizó
un Espectrofotómetro de Infrarrojo Jasco FT/
IR-4100 del Laboratorio de Química Analítica e
Instrumental de la Escuela Superior Politécnica
Tapia, Tobar, Acurio, Betún, Basurto

36
ISSN 2477-9105 Número 23 Vol.1 (2020)
de Chimborazo. Este equipo permitió el análisis
de una pequeña muestra del complejo sintetiza-
do permitiendo la obtención de la Figura 2 y la
Tabla 4 que muestran la transmitancia óptica,
una medida de la cantidad de luz que atraviesa
un cuerpo en una determinada longitud de onda.
Los valores de transmitancia permiten identifi-
car los diversos grupos funcionales presentes en
una sustancia.
III. RESULTADOS
La síntesis en laboratorio permitió la obtención
de trioxalatoferrato (III) de potasio en forma de
cristales por medio de precipitación y filtración
por gravedad. Luego, el producto fue sometido
a secado donde se evidenció la pérdida de masa
que se presenta en la Tabla 3.
Sustancia Peso(g) / vo-
lumen (ml)
Estado
físico
Color
Cristales luego
de ltrado
41.20 g sólido Verde esmeralda
Cristales luego
de secado
38.417 g sólido Verde pálido
Solución ltrada 90 ml líquido Verde claro
Tabla 3. Resultados de la práctica de obtención de cristales
de trioxalatoferrato (III) de potasio.
El análisis por espectrofotometría infrarroja per-
mitió obtener la Figura 2 donde el eje horizontal
representa el número de onda y el eje vertical la
transmitancia. Los picos más prominentes co-
rresponden a los grupos funcionales presentes en
mayor porcentaje en la estructura del compuesto
analizado.
Figura 2. Espectro Infrarrojo del Trioxalatoferrato (III) de potasio obteni-
do en la investigación.
Fuente: Laboratorio de Química Analítica e Instrumental, ESPOCH, 2019
Figura 3. Referencia: Espectro Infrarrojo del Trioxalatoferrato (III) de
potasio obtenido por Castro (3)
Fuente: Castro (3), Universidad del Valle, Colombia, 2016
La Tabla 4 muestra números de onda y trans-
mitancia donde los valores resaltados con colores
son característicos de diversos grupos funciona-
les que pudieron ser identificados debido a los
picos más prominentes de la Figura 2.
Wavenumber [cm-1] %T
2339.23 94.4268
1711.51 86.9071
1678.73 82.8062
1639.2 83.328
1384.64 81.5736
1312.32 94.9986
1270.86 85.8537
1255.43 86.9623
890.952 94.2814
798.385 89.158
788.743 88.588
629.644 95.1195
593.968 93.345
584.325 91.021
Tabla 4. Número de onda y Transmitancia de los grupos químicos
presentes en mayor cantidad en el compuesto obtenido
Fuente: Laboratorio de Química Analítica e Instrumental, ESPOCH, 2019
Con los valores de número de onda obtenidos
se procedió a la comparación de los valores con
otros referenciales dados por el trabajo de investi-
gación y síntesis del mismo compuesto realizado
por el autor Castro (3) en el año 2016. En la Tabla
5 se puede observar que los valores del comple-
jo obtenido con respecto a las bandas (grupos
químicos representativos) son muy cercanos a
los valores tomados como referencia. También
se incluyeron los valores de longitud de onda del
ácido oxálico para evidenciar la presencia de en-
laces dobles carbono-oxígeno que son caracterís-

37
Tapia, Tobar, Acurio, Betún, Basurto
ticos del grupo oxalato.
Bandas
Longitud de onda (cm-1)
Ácido
oxálico
referencia
Complejo
Referencia
Castro (3)
Complejo obtenido
Resultados IR
Vibraciones
asimétricas
--- 1715.75 1711.51
Enlaces dobles
carbono-oxigeno
1685 1682.96 1678.73
Enlaces simples
carbono-oxigeno
1360 1388.80 1384.64
Vibraciones
simétricas
1263- 903 1265.35 –
891.15
1270.86 – 890.952
Grupo oxalato --- 781.20 788.743
Agua en red
cristalina
579 590.24 593.968
Enlaces simples
Hierro-Oxigeno
--- 533.34 584.325
Tabla 5. Comparación de valores de longitud de onda del compuesto obtenido
con valores de referencia del ácido oxálico y de la síntesis del autor Castro (3)
Fuente: Laboratorio de Química Analítica e Instrumental, ESPOCH, 2019
Figura 4. Filtración, secado y almacenado del compuesto de coordinación
obtenido: trioxalatoferrato (III) de potasio.
IV. DISCUSIÓN
En la presente investigación, la síntesis de
trioxalatoferrato (III) de potasio se realizó a par-
tir de diferentes reacciones químicas en las cua-
les se obtuvieron paso a paso los iones de oxalato
y ferrato (III) necesarios para la formación del
ion complejo oxalatoferrato y su posterior unión
al contraión del metal potasio para la obtención
de un compuesto de coordinación. El proceso de
síntesis en el laboratorio tuvo un rendimiento del
78.41% considerado como satisfactorio el cual
estuvo determinado por variables y factores de
temperatura, agitación y pureza de reactivos. En
la Figura 4 se puede visualizar los cristales ob-
tenidos que posteriormente fueron sometidos a
secado.
Existen otros métodos de laboratorio para la ob-
tención del trioxalatoferrato (III) de potasio que
se basan en la utilización de distintos reactivos
y por consecuencia involucran reacciones quími-
cas diferentes, sin embargo llegan al mismo obje-
tivo. Como ejemplo se puede citar la práctica del
repositorio de la Facultad de Ciencias Químicas
de la Universidad Complutense de Madrid rea-
lizada en el año 2011, en la cual se emplean sal
de Mohr, ácido sulfúrico y oxalato ferroso. Esta
práctica también difiere en el método de obten-
ción de los cristales ya que utiliza el baño de hielo
en lugar del reposo de la solución durante 24 ho-
ras, el cual es un procedimiento mucho más rápi-
do pero puede afectar a la calidad de los cristales
debido a la aceleración del proceso por descenso
de la temperatura (6).
El método de filtración por gravedad empleado
puede ser sustituido por la filtración al vacío, de
esa forma se podría eliminar mayor cantidad de
agua y otras sustancias presentes en los cristales.
Se empleó etanol para el lavado de los cristales ya
que es un solvente volátil que no produce reac-
ción alguna con el trioxalatoferrato (III) de pota-
sio y es necesario emplearlo con su máximo nivel
de concentración posible que para este trabajo
fue del 96%.
Luego de la obtención de los cristales del com-
puesto de coordinación se procedió a su secado
durante 45 minutos a una temperatura de 60 °C
con ayuda de un equipo secador de bandejas lo
cual permitió una significativa deshidratación
del compuesto con una pérdida total de 2.78 g en
masa con respecto a la masa inicial de los crista-
les (Ver Tabla 3), sin embargo la sustancia debe
mantenerse en su forma trihidratada para que
no se vean alteradas las propiedades químicas del
Fe +3. Para el secado del compuesto la tempera-
tura no debe exceder los 113 °C que es el límite
de temperatura para la forma hidratada del com-
puesto que debe guardar agua de cristalización.
Para la caracterización del compuesto se utilizó
un análisis por espectrofotometría infrarroja que
permitió obtener las Tablas 4 y 5 para la compa-
ración de los números de onda con los valores
obtenidos en la práctica de síntesis realizada por
el autor Castro (3). Se puede observar en la Tabla
5 que los valores de las bandas características de
los iones oxalato guardan mucha similitud con

38
ISSN 2477-9105 Número 23 Vol.1 (2020)
los valores de referencia sin embargo se obtuvo
mayor intensidad de bandas de agua de crista-
lización que indican una mayor hidratación del
compuesto. Con este análisis se puede asegurar
que el compuesto de coordinación obtenido es
trioxalatoferrato (III) de potasio.
Aplicación del compuesto de coordinación
El compuesto obtenido, trioxalatoferrato (III) de
potasio, tiene su aplicación en la técnica de co-
pia fotográfica monocromática conocida como
cianotipia. Para esta aplicación se requiere una
disolución fotosensible compuesta de dos sustan-
cias químicas: trioxalatoferrato (III) de potasio
y hexacianoferrato (III). Ambos compuestos se
combinan en una relación 2:1 con agua destila-
da. Esta relación se obtuvo mediante ensayos ex-
perimentales. La disolución debe ser preparada
en un ambiente oscuro y almacenada en botellas
opacas para ser utilizada como pintura que es
aplicada sobre papel o cartulina para dejar secar
en ambiente sin luz. Luego se necesita una hoja
de acetato con una imagen impresa en negativo
o un cuerpo plano como hojas o flores para fi-
nalmente ser colocada sobre la hoja pintada y ser
expuesta a radiación ultravioleta que se obtiene
por exposición a la luz solar durante 20 minutos
aproximadamente.
El principio del funcionamiento de este proceso
se encuentra en la foto sensibilidad del complejo
de hierro del compuesto de coordinación previa-
mente obtenido. El átomo central Fe tiene un nú-
mero de oxidación +3 coordinado con tres gru-
pos carboxilatos. Los rayos ultravioleta de la luz
solar tienen la energía suficiente para excitar el
complejo trioxalatoferrato (III) y volverlo ines-
table, para luego sufrir una reacción de reduc-
ción interna donde el átomo de Fe +3 se oxida a
Fe +2, combinándose directamente con el ferro-
cianuro de potasio en el interior de las fibras de
papel que forman un precipitado de color azul.
La reacción de foto sensibilidad del complejo en
el compuesto de coordinación puede ser descrita
con la siguiente ecuación química:
(1)
Luego del proceso de exposición a la luz solar, la
parte que no fue expuesta a la luz según el dise-
ño del dibujo de la hoja de acetato o de la silueta
de un cuerpo sólido, queda casi sin coloración a
diferencia de la parte del diseño que fue expuesta
a la luz del sol. Finalmente se lava la hoja en una
bandeja con agua fría para remover los quími-
cos solubles de la superficie y obtener una im-
presión fotográfica. El proceso de cianotipia no
se restringe únicamente a superficies de papel
sino también puede ser realizado sobre superfi-
cies absorbentes como madera, algodón y cuero
para crear diseños y objetos interesantes. En la
figura 4 se puede observar una prueba de ciano-
tipia realizada sobre papel que se cubrió con una
disolución de trioxalatoferrato (III) de potasio y
ferrocianuro de potasio.
Figura 5. Impresión monocromática de la silueta de una tijera
por cianotipia
V. CONCLUSIONES
Se obtuvo un valor de 40.20 g de cristales de
trioxalatoferrato (III) de potasio gracias a la uti-
lización de la cantidad adecuada de reactivos que
requiere mucha precisión durante su medición
y peso. Luego del secado, los cristales perdieron
masa llegando a un valor de 38.4 g lo cual in-
dica que se sintetizó el compuesto en su forma
hidratada. El rendimiento de la reacción fue del
78.41%.
Se identificaron reacciones químicas por pasos
en cada etapa de preparación de la disolución
que dieron lugar a la precipitación de los crista-

R
eferencias
39
les del compuesto de coordinación sintetizado.
Estas reacciones involucraron la formación de
iones cuando los reactivos sólidos entraron en
contacto con el medio acuoso. La disociación de
los reactivos permitió la formación de los iones
complejos necesarios para la formación del com-
puesto de coordinación.
Se encontró una aplicación factible para el
trioxalatoferrato (III) de potasio que consiste en
actuar como componente principal en el proceso
de revelado fotográfico monocromático conocido
como cianotipia. El compuesto de coordinación
a diferencia de otras sales de hierro reacciona con
el ferrocianuro de potasio produciendo una co-
loración fija en papel luego del revelado con una
tonalidad de color azul acentuada. Este proceso
se fundamenta en la reacción de reducción del Fe
+3 contenido en el complejo de coordinación a Fe
+2 por acción de la radiación ultravioleta.
1. Huheey J, Keiter E, Keiter R. Química Inorgánica: Principios de estructura y reactividad. 4a ed. Mé-
xico: Alfaomega; 2005.
2. Chang R. Química. 10 a ed. México: The McGraw-Hill; 2010.
3. Castro N, Domínguez I, Figueroa V. Síntesis y utilización de métodos espectroscópicos para el aná-
lisis del tris oxalato ferrato (III) de potasio. [Internet]. Colombia: Universidad del Valle; 2016 [citado 19 Junio
2019]. Disponible en: https://mavoden.weebly.com/uploads/3/8/7/6/38767835/inform._tris_oxalato.pdf
4. Solarte L, Rosero M. Síntesis y Caracterización del Tris(Oxalato)Ferrato (III) de Potasio trihidra-
tado. [Internet]. Colombia: Academia; 2015 [citado 19 Junio 2019]. Disponible en: https://www.academia.
edu/19264155/S%C3%ADntesis_y_Caracterizaci%C3%B3n_del_Tris_Oxalato_Ferrato_III_De_Potasio
5. Shurvell H. Spectra-Structure in the Mid- and Far- infrared Queen's University. [Internet]. Canadá : Wi-
ley ; 2006 [citado 20 Junio 2019]. Disponible en : https://onlinelibrary.wiley.com/doi/abs/10.1002/0470027320.
s4101
6. Cabañas. M. Ficha Docente: QUÍMICA INORGÁNICA. [Internet]. Madrid: Universidad Complu-
tense de Madrid; 2012 [citado 19 Junio 2019]. Disponible en: https://www.ucm.es/data/cont/media/www/pag-
73249/QI11-12.pdf
7. Universidad de Santiago de Compostela. Manual de Laboratorio de Química Inorgánica II. [Inter-
net]. España: Galicia; 2014. Disponible en: http://www.usc.es/export9/sites/webinstitucional/gl/centros/qui-
mica/curso/grao/Manual_laboratorio_QI2_2013_14s.pdf
8. Tovar, C. Química Inorgánica: Preparación de un compuesto de coordinación: K3[Fe(ox)3]·3H2O.
[Internet]. Colombia: Universidad de Cartagena; 2014. Disponible en: http://dec.fq.edu.uy/catedra_inorgani-
ca/inorganica/practica12.pdf
9. Gale P. Coordination Chemistry Reviews.376 vol. UK: Editorial ELSEVIER; 2018.
10. Walter de Gruyter. Reviews in Inorganic Chemistry. 1ª ed. Germany: Aldrige; 2018.
11. Housecroft C, Sharpe A. Inorganic Chemistry. 2ª ed. London: Pearson Education Limited; 2005.
12. Connelly N, Damhus T. Huttin A. Nomenclature of Inorganic Chemistry. 1ª ed. UK: Editorial Rever-
té; 2005.
13. Rayner G. Química Inorgánica Descriptiva. 2ª ed. México: Pearson Educación; 2000.
14. E. Quiñoá, R. Riguera, J. Nomenclatura y formulación de los compuestos inorgánicos. 3ª ed. España:
McGraw Hill; 2006.
15. Atkins P, Overton T, Rourke J, Weller M, Armstrong. Química Inorgánica. 4ª ed. China: McGraw-Hi-
ll Interamericana; 2008.
16. Villa M, Aguilar J. Química Inorgánica: Manual de Practicas. 3ª ed. Colombia: Universidad de Me-
dellín; 2014.
17. Peterson W. Introduccion a la nomenclatura de las sustancias químicas. 2ª ed. España: Reverté; 2011.
18. Garces A, Gomez S. Experimentación en Química Inorganica..1ª ed. España: S.LDykinson;2009.
19. VV.AA. Formulación y Nomenclatura. Química Inorgánica. 1ª ed. España:Oxford;2013.
20. Quiñoa E. Nomeclatura y Formulación de los compuestos inorgánicos. 1ª ed. España: S.A. MC-
GRAW-HILL;2006.
21. Leite A. Química Inorgánica II.1ª ed. Ceará: UAB/UECE;2015.
22. Petrucci R. Química General, principios y aplicaciones modernas. 10ª ed. Madrid: Pearson educa-
ción; 2011.
Tapia, Tobar, Acurio, Betún, Basurto

40
ISSN 2477-9105 Número 23 Vol.1 (2020)
23. Álvarez J. Química Inorgánica y Química orgánica. [Internet]. Madrid: Universidad Politécnica de
Madrid; 2014. Disponible en: http://quim.iqi.etsii.upm.es/moles/TEXTOS/Q.%20INORGANICA%20Y%20
Q.%20ORGANICA.pdf
24. Gutiérrez M, López L. Química 1. 2ª ed. México: Pearson; 2018.
25. López L, Gutiérrez M, Arellano L. 3ª ed. México: Pearson: 2012.